题目内容
5.混合气体,可能含有下列气体中的某几种:NH3、O2、NO、Cl2、HCl,在温度和压强不变的情况下进行如下实验,写出每步可以肯定的结论:| 实 验 现 象 | 可 以 肯 定 的 结 论 |
| A、观察混合气体无色 | 无Cl2、 |
| B、将混合气体通过浓H2SO4,体积减小 | 有NH3、无HCl |
| C、剩余气体跟空气接触后变为红棕色 | 有NO、无O2 |
分析 A、观察混合气体无色,则一定不存在有色气体:Cl2;
B、将混合气体通过浓H2SO4,体积减小,则一定存在与硫酸反应的气体NH3,一定不存在与氨气反应的氯化氢;
C、剩余气体跟空气接触后变为红棕色,该红棕色气体为二氧化氮,则原气体中一定含有NO,一定不存在与NO反应的氧气,据此进行解答.
解答 解:A、观察混合气体无色,由于氯气为黄绿色气体,则一定不存在Cl2,故答案为:Cl2;
B、将混合气体通过浓H2SO4,体积减小,则一定存在与硫酸反应的NH3,由于氨气与HCl发生反应,则一定不存在HCl,故答案为:NH3;HCl;
C、剩余气体跟空气接触后变为红棕色,该红棕色气体为NO2,说明原气体中一定含有NO,则一定不存在与NO反应的气体O2,故答案为:NO;O2.
点评 本题考查了常见气体的性质及检验方法,题目难度中等,明确常见气体的性质及检验方法为解答关键,注意明确常见的颜色气体、遇到空气变成红棕色的气体,常常为推断题的突破口.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
15.已知某主族元素R原子有三个电子层,其气态氢化物的化学式为HR,下列叙述中不正确的是( )
| A. | 该元素的原子最外电子层上有7个电子 | |
| B. | 该元素的最高正价氧化物的化学式为R2O7 | |
| C. | 该元素可能是金属元素 | |
| D. | 该元素最高价氧化物对应的水化物的化学式为HRO4 |
16.向某溶液中加入BaCl2溶液,出现白色沉淀,再加入稀硝酸,白色沉淀不溶解,则该溶液不可能是( )
| A. | Na2CO3 | B. | AgNO3 | C. | Na2SO3 | D. | Na2SO4 |
13.4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性.(CN)2称为拟卤素,性质与卤素相似.下列说法不正确的是( )
| M | N | ||
| X | Y |
| A. | X位于三周期 IIA,其单质可采用电解熔融MgCl2制备 | |
| B. | 元素最高价氧化物的水化物中,酸性最强的是HNO3 | |
| C. | 气体分子(MN)2 的电子式为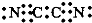 | |
| D. | (MN)2其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=2NaCN+H2O |
20.下列叙述不正确的是( )
| A. | 生铁中含有碳,抗腐蚀能力比纯铁弱 | |
| B. | 用锡焊接的铁质器件,焊接处易生锈 | |
| C. | 在铁制品上镀铜时,镀件(待镀金属)为阳极,铜盐为电镀液 | |
| D. | 铁制钥匙表面镀上一层锌,钥匙不易被腐蚀 |
10.硅是一种重要的非金属单质,其化学性质与碳既有相似之处,也有不同之处.在常温下,下列物质能够与硅发生反应的是( )
| A. | HF | B. | HNO3 | C. | NaCl | D. | H2SO4 |
17.下列选项中,在熔化和水溶液状态下,破坏作用力相同的是( )
| A. | HCl | B. | 冰醋酸 | C. | Na2SO4 | D. | KOH |
14.已知:Ⅰ.4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1269kJ/mol
Ⅱ.
Ⅱ.

| A. | 断开1mol O-O键比断开1mol N-N键所需能量少448kJ | |
| B. | 断开1mol H-O键与断开1mol H-N键所需能量相差约72.6kJ | |
| C. | 由以上键能的信息可知H2O的沸点比NH3高 | |
| D. | 由元素非金属性的强弱可知H-O键比H-N键弱 |
14.下列关于物质结构的叙述中正确的是( )
| A. | 分子晶体中一定含有共价键 | |
| B. | 离子晶体中一定含有离子键 | |
| C. | 含有极性键的分子一定是极性分子 | |
| D. | 含有非极性键的分子一定是非极性分子 |