题目内容
16.向某溶液中加入BaCl2溶液,出现白色沉淀,再加入稀硝酸,白色沉淀不溶解,则该溶液不可能是( )| A. | Na2CO3 | B. | AgNO3 | C. | Na2SO3 | D. | Na2SO4 |
分析 向某溶液中加入BaCl2溶液,再加入稀硝酸,产生的白色沉淀不消失,可能生成的沉淀为AgCl或生成BaSO4;原溶液中可能含有银离子、亚硫酸根离子或硫酸根离子中的一种,据此进行解答.
解答 解:如溶液中含有SO32-,能被硝酸氧化为SO42-,加入BaCl2溶液生成BaSO4,
因加入的为BaCl2,可能生成AgCl,二者都不溶于水,所以溶液中可能含有SO42-、SO32-、Ag+离子中的一种,即:该溶液可能为AgNO3或Na2SO3或Na2SO4,
由于碳酸钡能够溶于稀硝酸,所以该溶液不可能为碳酸钠溶液,
故选A.
点评 本题考查了常见离子的检验方法,题目难度中等,注意掌握常见离子的性质及检验方法,明确检验离子存在时需要排除干扰,确保检验方案的严密性.

练习册系列答案
相关题目
6.某溶液中存在大量的H+、Cl-、Ba2+,该溶液中还可能大量存在的是( )
| A. | Al3+ | B. | S2- | C. | SO${\;}_{4}^{2-}$ | D. | HCO3- |
7.下列物质中,都不能与Ag(NH3)2OH溶液发生银镜反应的一组是( )
①福尔马林;②蚁酸;③甲酸乙酯;④乙酸甲酯;⑤甲酸钠;⑥醋酸;⑦葡萄糖;⑧蔗糖;⑨麦芽糖.
①福尔马林;②蚁酸;③甲酸乙酯;④乙酸甲酯;⑤甲酸钠;⑥醋酸;⑦葡萄糖;⑧蔗糖;⑨麦芽糖.
| A. | ①②③④ | B. | ④⑥⑧ | C. | ⑦⑧⑨ | D. | ⑤⑥⑦⑧ |
4.X、Y、Z均为中学化学常见物质,在一定条件下,X能与强酸或强碱溶液发生如下图的反应(部分反应物、生成物及反应条件略去).则下列说法不正确的是( )
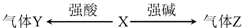
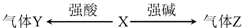
| A. | 若X为金属单质,则Y、Z可能为同一物质 | |
| B. | 若X为盐,则Y在标况下的密度一定是1.96g•L-1 | |
| C. | 若X为盐,则Z一定能使湿润的红色石蕊试纸变蓝 | |
| D. | 若X为盐,则其水溶液中水的电离程度比同温度下纯水的电离程度大 |
11.下列装置所示的实验中,能达到实验目的是( )
| A. |  CCl4萃取I2后从下口放出水层 | B. | 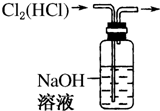 除去Cl2中的HCl | ||
| C. | 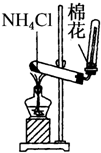 实验室制氨气 | D. | 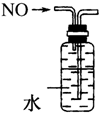 排水法收集NO |
8.下列有关电池及能源的叙述正确的是( )
| A. | 锌锰干电池工作一段时间后碳棒变细 | |
| B. | 铅蓄电池工作一段时间后酸性会增强 | |
| C. | 水和水煤气都是一级能源 | |
| D. | 铁与H2SO4反应时,加入少量CuSO4溶液时,可使反应加速 |
5.混合气体,可能含有下列气体中的某几种:NH3、O2、NO、Cl2、HCl,在温度和压强不变的情况下进行如下实验,写出每步可以肯定的结论:
| 实 验 现 象 | 可 以 肯 定 的 结 论 |
| A、观察混合气体无色 | 无Cl2、 |
| B、将混合气体通过浓H2SO4,体积减小 | 有NH3、无HCl |
| C、剩余气体跟空气接触后变为红棕色 | 有NO、无O2 |
5.某有机物X的结构简式如下图所示,则下列有关说法中正确的是( )


| A. | 有机物X的含氧官能团有3种 | |
| B. | X分子中苯环上的一氯取代物有3种 | |
| C. | 在Ni作催化剂的条件下,1mol X 最多能与5 mol H2加成 | |
| D. | X在一定条件下能发生加成、取代、消去等反应 |
 下列各组物质,不能按照图关系相互转化的是(“→”表示反应一步完成)( )
下列各组物质,不能按照图关系相互转化的是(“→”表示反应一步完成)( )