题目内容
10.硅是一种重要的非金属单质,其化学性质与碳既有相似之处,也有不同之处.在常温下,下列物质能够与硅发生反应的是( )| A. | HF | B. | HNO3 | C. | NaCl | D. | H2SO4 |
分析 常温下硅性质不活泼,高温时,硅能够与许多物质发生反应,硅常温下能够与氢氟酸能够发生反应,据此解答.
解答 解:硅常温下性质稳定,不与硝酸、氯化钠和硫酸发生反应,但是常温下硅能够与氢氟酸反应生成四氟化硅和水,
故选:A.
点评 本题考查了元素化合物知识,熟悉硅的性质是解题关键,题目难度不大,侧重对基础知识的考查.

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案
相关题目
20.两种元素可形成AB2型化合物,它们的原子序数是( )
| A. | 3和9 | B. | 6和8 | C. | 10和14 | D. | 7和12 |
18.666℃和1.01×105 Pa时,反应“CaCO3(s)═CaO(s)+CO2(g)△H=+178.3kJ/mol”能自发进行的原因是( )
| A. | 温度升高 | B. | 该反应熵增 | ||
| C. | 熵增效应大于能量效应 | D. | 反应速率加快 |
5.混合气体,可能含有下列气体中的某几种:NH3、O2、NO、Cl2、HCl,在温度和压强不变的情况下进行如下实验,写出每步可以肯定的结论:
| 实 验 现 象 | 可 以 肯 定 的 结 论 |
| A、观察混合气体无色 | 无Cl2、 |
| B、将混合气体通过浓H2SO4,体积减小 | 有NH3、无HCl |
| C、剩余气体跟空气接触后变为红棕色 | 有NO、无O2 |
15.W、R、X、Y、Z是五种短周期元素,部分信息如表所示:
请回答下列问题:
(1)Z的元素符号可能是H、Be、Al;
(2)XW3能使红色湿润石蕊试纸变蓝色;
(3)Y和R元素组成常见的化合物的化学式为CO2或SiO2;
(4)画出Y的简单离子结构示意图: .
.
| 元素代号 | 部分信息 |
| W | W是一种核素没有中子 |
| R | R原子的最外层电子数等于K层电子数的2倍 |
| X | X原子得到3个电子达到稳定结构,单质在常温、常压下呈气态 |
| Y | Y原子的最外层电子数是电子层数的3倍 |
| Z | Z原子的电子层数等于最外层电子数 |
(1)Z的元素符号可能是H、Be、Al;
(2)XW3能使红色湿润石蕊试纸变蓝色;
(3)Y和R元素组成常见的化合物的化学式为CO2或SiO2;
(4)画出Y的简单离子结构示意图:
 .
.
2.已知,将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3 ,且$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$的值与温度高低有关,当n(KOH)=a mol时,下列有关说法错误的是( )
| A. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{{O}_{3}}^{-})}$=$\frac{1}{2}$ | |
| B. | 参加反应的氯气的物质的量小于$\frac{1}{2}$a mol | |
| C. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$a mol≤ne≤$\frac{5}{6}$a mol | |
| D. | 改变温度,产物中KC1O3的最大理论产量为$\frac{1}{7}$a mol |
19.常温下,将一定量的氯气通入100mL 4mol/L的氢氧化钠溶液中,发生反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O.充分反应后,下列说法正确的是(NA为阿伏加德罗常数)( )
| A. | 当通入的Cl2为2.24 L时,反应中电子转移数目为0.1 NA | |
| B. | 当溶液中Na+为0.4 NA时,溶液中的Cl-为0.2 NA | |
| C. | 当电子转移数目为0.2 NA时,溶液质量增加14.2 g | |
| D. | 当溶液质量增加7.1 g时,溶液中ClO-为0.1 NA |
 下列各组物质,不能按照图关系相互转化的是(“→”表示反应一步完成)( )
下列各组物质,不能按照图关系相互转化的是(“→”表示反应一步完成)( )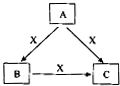 A、B、C、X是中学化学常见物质,均由短周期元素组成,且均为气体,转化关系如图所示(图中部分产物及条件已略去).A的大量人工合成是化学对人类社会的卓越贡献之一,请回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,且均为气体,转化关系如图所示(图中部分产物及条件已略去).A的大量人工合成是化学对人类社会的卓越贡献之一,请回答: