题目内容
13.4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性.(CN)2称为拟卤素,性质与卤素相似.下列说法不正确的是( )| M | N | ||
| X | Y |
| A. | X位于三周期 IIA,其单质可采用电解熔融MgCl2制备 | |
| B. | 元素最高价氧化物的水化物中,酸性最强的是HNO3 | |
| C. | 气体分子(MN)2 的电子式为 | |
| D. | (MN)2其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=2NaCN+H2O |
分析 4种元素都是短周期元素,且为相邻主族,根据元素在周期表中的位置知,M和N位于第二周期、X和Y位于第三周期,X原子核外电子数是M的2倍,Y的氧化物具有两性,则Y是Al元素,根据元素相对位置可知,X是Mg元素、M是C元素、N元素为N元素,据此结合元素周期律知识进行解答.
解答 解:4种元素都是短周期元素,且为相邻主族,根据元素在周期表中的位置知,M和N位于第二周期、X和Y位于第三周期,X原子核外电子数是M的2倍,Y的氧化物具有两性,则Y是Al元素,根据元素相对位置可知,X是Mg元素、M是C元素、N元素为N元素,
A.元素X是Mg元素,其原子序数为12,在周期表中的位置是第三周期第IIA族,镁单质可采用电解熔融MgCl2制备,故A正确;
B.M、N、X、Y分别是C、N、Mg、Al,元素的非金属性越强,其最高价氧化物的水化物酸性越强,这四种种元素中非金属性最强的是N元素,所以酸性最强的是HNO3,故B正确;
C.气体分子(MN)2为(CN)2,其电子式为: ,故C正确;
,故C正确;
D.根据氯气和氢氧化钠溶液反应知,(CN)2和NaOH反应生成NaCN、NaOCN、H2O,反应方程式为:2NaOH+(CN)2=NaCN+NaOCN+H2O,故D错误;
故选D.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,根据元素在周期表中物质及元素性质确定元素,再结合物质的性质分析解答,采用知识迁移的方法分析D.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.如图可用来发生、洗涤、干燥、收集(不考虑尾气处理)气体.该装置可用于( )
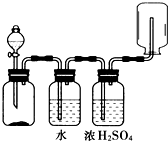

| A. | NaCl(s)+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HCl↑ | B. | 二氧化锰和浓盐酸生成氯气 | ||
| C. | 碳酸钙和盐酸生成二氧化碳 | D. | 锌和盐酸生成氢气 |
4.X、Y、Z均为中学化学常见物质,在一定条件下,X能与强酸或强碱溶液发生如下图的反应(部分反应物、生成物及反应条件略去).则下列说法不正确的是( )
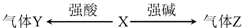
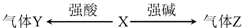
| A. | 若X为金属单质,则Y、Z可能为同一物质 | |
| B. | 若X为盐,则Y在标况下的密度一定是1.96g•L-1 | |
| C. | 若X为盐,则Z一定能使湿润的红色石蕊试纸变蓝 | |
| D. | 若X为盐,则其水溶液中水的电离程度比同温度下纯水的电离程度大 |
8.下列有关电池及能源的叙述正确的是( )
| A. | 锌锰干电池工作一段时间后碳棒变细 | |
| B. | 铅蓄电池工作一段时间后酸性会增强 | |
| C. | 水和水煤气都是一级能源 | |
| D. | 铁与H2SO4反应时,加入少量CuSO4溶液时,可使反应加速 |
18.666℃和1.01×105 Pa时,反应“CaCO3(s)═CaO(s)+CO2(g)△H=+178.3kJ/mol”能自发进行的原因是( )
| A. | 温度升高 | B. | 该反应熵增 | ||
| C. | 熵增效应大于能量效应 | D. | 反应速率加快 |
5.混合气体,可能含有下列气体中的某几种:NH3、O2、NO、Cl2、HCl,在温度和压强不变的情况下进行如下实验,写出每步可以肯定的结论:
| 实 验 现 象 | 可 以 肯 定 的 结 论 |
| A、观察混合气体无色 | 无Cl2、 |
| B、将混合气体通过浓H2SO4,体积减小 | 有NH3、无HCl |
| C、剩余气体跟空气接触后变为红棕色 | 有NO、无O2 |
2.已知,将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3 ,且$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$的值与温度高低有关,当n(KOH)=a mol时,下列有关说法错误的是( )
| A. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{{O}_{3}}^{-})}$=$\frac{1}{2}$ | |
| B. | 参加反应的氯气的物质的量小于$\frac{1}{2}$a mol | |
| C. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$a mol≤ne≤$\frac{5}{6}$a mol | |
| D. | 改变温度,产物中KC1O3的最大理论产量为$\frac{1}{7}$a mol |
 下列各组物质,不能按照图关系相互转化的是(“→”表示反应一步完成)( )
下列各组物质,不能按照图关系相互转化的是(“→”表示反应一步完成)( )