题目内容
15.已知某主族元素R原子有三个电子层,其气态氢化物的化学式为HR,下列叙述中不正确的是( )| A. | 该元素的原子最外电子层上有7个电子 | |
| B. | 该元素的最高正价氧化物的化学式为R2O7 | |
| C. | 该元素可能是金属元素 | |
| D. | 该元素最高价氧化物对应的水化物的化学式为HRO4 |
分析 已知某主族元素R原子有三个电子层,为第三周期元素,元素R的气态氢化物的化学式为HR,则R元素最低负化合价为-1,其最高正化合价为+7,属于第VIIA族元素,所以R为Cl元素,结合化合价判断最外层电子数及相应化学式.
解答 解:已知某主族元素R原子有三个电子层,为第三周期元素,元素R的气态氢化物的化学式为HR,则R元素最低负化合价为-1,其最高正化合价为+7,属于第VIIA族元素,所以R为Cl元素,
A.R元素最低负化合价为-1,其最高正化合价为+7,则原子最外电子层上有7个电子,故A正确;
B.该元素的原子高正价为+7,则最高正化合价氧化物的化学式为R2O7,故B正确;
C.由分子可知,R为Cl元素,为非金属元素,故C错误;
D.该元素的原子高正价为+7,该元素最高价氧化物对应的水化物的化学式为HRO4,故D正确,
故选C.
点评 本题考查原子结构与元素周期律,难度不大,注意根据元素化合价进行分析解答,注意把握最高正价与负价的关系.

练习册系列答案
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
5.下列有关乙醇的性质的应用中正确的是( )
| A. | 由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去 | |
| B. | 由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分 | |
| C. | 乙醇能与乙酸在一定条件下反应生成乙酸乙酯和水,说明乙醇具有碱性 | |
| D. | 由于乙醇容易挥发,所以才有熟语“酒香不怕巷子深”的说法 |
6.某溶液中存在大量的H+、Cl-、Ba2+,该溶液中还可能大量存在的是( )
| A. | Al3+ | B. | S2- | C. | SO${\;}_{4}^{2-}$ | D. | HCO3- |
3.如图可用来发生、洗涤、干燥、收集(不考虑尾气处理)气体.该装置可用于( )
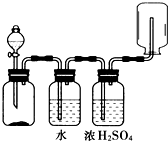

| A. | NaCl(s)+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HCl↑ | B. | 二氧化锰和浓盐酸生成氯气 | ||
| C. | 碳酸钙和盐酸生成二氧化碳 | D. | 锌和盐酸生成氢气 |
10.“绿色化学”是指从技术、经济上设计可行的化学反应或化工设备,尽可能地节约能源,或尽可能减少对环境的负作用.下列选项中不符合绿色化学概念的是( )
| A. | 工业生产硫酸、硝酸的设备中安装热交换器 | |
| B. | 消除制硝酸工业尾气的氮氧化物污染:NO+NO2+2NaOH═2NaNO2+H2O | |
| C. | 消除硫酸厂尾气中的SO2:SO2+2NH3•H2O═(NH4)2SO3+H2O | |
| D. | 用废铜屑制CuSO4:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O |
20.两种元素可形成AB2型化合物,它们的原子序数是( )
| A. | 3和9 | B. | 6和8 | C. | 10和14 | D. | 7和12 |
7.下列物质中,都不能与Ag(NH3)2OH溶液发生银镜反应的一组是( )
①福尔马林;②蚁酸;③甲酸乙酯;④乙酸甲酯;⑤甲酸钠;⑥醋酸;⑦葡萄糖;⑧蔗糖;⑨麦芽糖.
①福尔马林;②蚁酸;③甲酸乙酯;④乙酸甲酯;⑤甲酸钠;⑥醋酸;⑦葡萄糖;⑧蔗糖;⑨麦芽糖.
| A. | ①②③④ | B. | ④⑥⑧ | C. | ⑦⑧⑨ | D. | ⑤⑥⑦⑧ |
4.X、Y、Z均为中学化学常见物质,在一定条件下,X能与强酸或强碱溶液发生如下图的反应(部分反应物、生成物及反应条件略去).则下列说法不正确的是( )
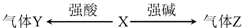
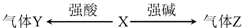
| A. | 若X为金属单质,则Y、Z可能为同一物质 | |
| B. | 若X为盐,则Y在标况下的密度一定是1.96g•L-1 | |
| C. | 若X为盐,则Z一定能使湿润的红色石蕊试纸变蓝 | |
| D. | 若X为盐,则其水溶液中水的电离程度比同温度下纯水的电离程度大 |
5.混合气体,可能含有下列气体中的某几种:NH3、O2、NO、Cl2、HCl,在温度和压强不变的情况下进行如下实验,写出每步可以肯定的结论:
| 实 验 现 象 | 可 以 肯 定 的 结 论 |
| A、观察混合气体无色 | 无Cl2、 |
| B、将混合气体通过浓H2SO4,体积减小 | 有NH3、无HCl |
| C、剩余气体跟空气接触后变为红棕色 | 有NO、无O2 |