��Ŀ����
20��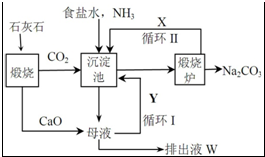 ̼������һ����Ҫ�Ļ�����Ʒ��һ�ֹ�ҵ����������ͼ��ʾ��
̼������һ����Ҫ�Ļ�����Ʒ��һ�ֹ�ҵ����������ͼ��ʾ����1���������з�����Ӧ�Ļ�ѧ����ʽΪNaCl+NH3+CO2+H2O�TNaHCO3��+NH4Cl��
��2��X��CO2��Y��NH3���ѧʽ����
��3���ų�ҺW�е����ʳ������������⣬����CaCl2��NaCl��
��4���������Ϸ����������������в���Ҫ�����Ҫ����������Ҫ�������䰱������ԭ�ϵ���Ʒ���÷����ܷ�Ӧ�����û�ѧ����ʽ��ʾ����дΪCaCO3+2NaCl�TNa2CO3+CaCl2��
��5��������ʱ��ÿͨ��NH344.8L�����ۺϳɱ�״���£����Եõ�����100.0g����NH3��������Ϊ94.3%��
���� ��������Ϊ������ʯ��ʯ���ɶ�����̼��CaO����������̼��������ʳ��ˮ�ڳ������з�����ӦNaCl+NH3+CO2+H2O=NaHCO3��+NH4Cl����̼�����ƣ�����̼����������̼���ơ�������̼�����ˮ����XΪCO2���ӳ������л�õ�ĸҺ�к����Ȼ�李�NaCl��ĸҺ�м��������ƣ��Ȼ���������Ʒ�Ӧ���ɰ������Ȼ��ƣ���YΪ�������ų�ҺW�к����������ơ�CaCl2��NaCl��
�������Ϸ������1����2����3����
��4��������������У�ĸҺ�м��������Ʒ�Ӧ�����������ƻ��������ɰ�������Ӧ�����а���ת��Ϊ��Σ����ת��Ϊ����������ѭ��ʹ�ã�����Ҫ���䰱�������ݷ�����Ӧ�ĸ�����ʽд���ܷ�Ӧ����ʽ��
��5�����ݷ�Ӧ�Ļ�ѧ����ʽ���㣬���ݷ�Ӧ����̼���Ƶ���������ʵ�����İ��������ʵ������õ������������ʣ�
��� �⣺��������Ϊ������ʯ��ʯ���ɶ�����̼��CaO����������̼��������ʳ��ˮ�ڳ������з�����ӦNaCl+NH3+CO2+H2O=NaHCO3��+NH4Cl����̼�����ƣ�����̼����������̼���ơ�������̼�����ˮ����XΪCO2���ӳ������л�õ�ĸҺ�к����Ȼ�李�NaCl��ĸҺ�м��������ƣ��Ȼ���������Ʒ�Ӧ���ɰ������Ȼ��ƣ���YΪ�������ų�ҺW�к����������ơ�CaCl2��NaCl��
��1���������з�����Ӧ�Ļ�ѧ����ʽΪ��NaCl+NH3+CO2+H2O�TNaHCO3��+NH4Cl��
�ʴ�Ϊ��NaCl+NH3+CO2+H2O�TNaHCO3��+NH4Cl��
��2�����ݷ�����֪�������п���ѭ�����õ�����XΪCO2��YΪNH3��
�ʴ�Ϊ��CO2��NH3��
��3������ų�Һ�е����ʳ������������⣬�����������ƺ��Ȼ�立�Ӧ���ɵ��Ȼ��Ƽ�ԭ��Һ�е��Ȼ��ƣ�
�ʴ�Ϊ��CaCl2��NaCl��
��4���������Ϸ��������������У�ĸҺ�м��������Ʒ�Ӧ�����������ƻ��������ɰ�������Ӧ�����а���ת��Ϊ��Σ����ת��Ϊ����������ѭ��ʹ�ã�����Ҫ���䰱����
���������з�����Ӧ�У�NaCl+NH3+CO2+H2O�TNaHCO3��+NH4Cl��CaCO3�TCaO+CO2����CaO+H2O�TCa��OH��2��Ca��OH��2+2NH4Cl�TCaCl2+2NH3��+2H2O��2NaHCO3�TNa2CO3+H2O+CO2���������ɵõ��ܻ�ѧ����ʽΪ��CaCO3+2NaCl�TNa2CO3+CaCl2��
�ʴ�Ϊ������Ҫ��CaCO3+2NaCl�TNa2CO3+CaCl2��
��5�������ķ�ӦΪ��NaCl+NH3+CO2+H2O�TNaHCO3��+NH4Cl��2NaHCO3�TNa2CO3+H2O+CO2����ÿ��ͨ��NH3 44.8L�����ۺϳɱ�״���£����ʵ���Ϊ��$\frac{44.8L}{22.4L/mol}$=2mol��
���������еõ�����100.0g�������ʵ���Ϊ��$\frac{100g}{106g/mol}$=$\frac{50}{53}$mol����Ҫ���������ʵ���Ϊ��$\frac{50}{53}$=$\frac{100}{53}$mol��
��NH3����������$\frac{\frac{100}{53}mol}{2mol}$��100%=94.3%��
�ʴ�Ϊ��94.3%��
���� ���⿼���˴��ҵԭ�����������̣���Ŀ�Ѷ��еȣ���ȷ�������̼�������Ӧԭ��Ϊ���ؼ���ע�����պ����Ƽ������ԭ����������ؿ���ѧ���ķ�����������������ѧʵ��������

| A�� | MgCl2 | B�� | H2O | C�� | K2O2 | D�� | NaOH |
| A�� | Na��H2O | B�� | NaCl��H2O | ||
| C�� | Na2O2��H2O | D�� | Na2CO3��Һ��Ca��OH��2��Һ |
| A�� | Na2O2 | B�� | H2O2 | C�� | H2 | D�� | HCl |
| A�� | H2O | B�� | H3O+ | C�� | CH4 | D�� | CO2 |
4NH3��g��+5O2��g��?4NO��g��+6H2O��g������Ӧ��ʼʱNH3��Ũ����1.0mol/L������20s������Ũ�ȱ����0.2mol/L������������䣬����20s��H2O�Ļ�ѧ��Ӧ����Ϊ��������
| A�� | 0.04 mol/��L•s�� | B�� | 0.06 mol/��L•s�� | C�� | 0.6 mol/��L•s�� | D�� | 0.8 mol/��L•s�� |
| A�� | ��ʹ��ˮ��ɫ������ʹ����KMnO4��Һ��ɫ | |
| B�� | ��һ�������£�������ʵ�����������Ӧ����1-���� | |
| C�� | �ܷ���������Ӧ�����ֳ������� | |
| D�� | ��һ�������£��ܱ�����Ϊ��ϩ�� |
| �����ܣ�KJ/mol�� | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
��2���ܣ�Co�����γɷ���ʽ��ΪCo��NH3��5BrSO4����������������һ����������Һ�м���AgNO3��Һʱ������������������Һ�м�BaCl2��Һʱ����������ɫ��������������Ļ�ѧʽΪ[Co��Br����NH3��5]SO4���������ӵ���λ��Ϊ6��
��3���ο��±��е������۵�ش���������
| ���� | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| �۵㣨�棩 | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
��4��C60������������ϣ�C60�Ľṹ��ͼ1����֪���ʯ�е�C-C�ļ���Ϊ154.45pm��C60��C-C����Ϊ145��140pm����ͬѧ�ݴ���ΪC60���۵���ڽ��ʯ������Ϊ�Ƿ���ȷ����ȷ������������C60�Ƿ��Ӿ��壬�ۻ�ʱ�����ƻ���ѧ������ѧ�Ұ�C60�ͼز�����һ��������һ�ָ���ϩ������侧����ͼ2��ʾ���������ڵ���ʱ��һ�ֳ����壬�����ʵ�Kԭ�Ӻ�C60���ӵĸ�����Ϊ3��1��
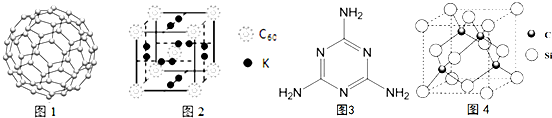 ��
����5�������谷���ӵĽṹ��ʽ��ͼ3�������е�ԭ�ӹ���ӻ�������sp2��sp3��l mol�����谷�����к�15mol�Ҽ���
��6��̼����ľ�������ʯ�ľ���������ͼ4���辧���߳�Ϊa cm��̼ԭ��ֱ��Ϊb cm����ԭ��ֱ��Ϊc cm����þ����Ŀռ�������Ϊ$\frac{2�У�{b}^{3}+{c}^{3}��}{3{a}^{3}}$��100%�����ú�a��b��c��ʽ�ӱ�ʾ����



