题目内容
5.下列微粒的立体结构与NH3相同的是( )| A. | H2O | B. | H3O+ | C. | CH4 | D. | CO2 |
分析 氨气分子中N原子价层电子对个数=3+1212×(5-3×1)=4且含有一个孤电子对,则氨气分子是三角锥形结构,物质的立体结构和氨气分子相同,说明该分子也是三角锥形结构,根据价层电子对互斥理论来分析解答.
解答 解:氨气分子中N原子价层电子对个数=3+1212×(5-3×1)=4且含有一个孤电子对,则氨气分子是三角锥形结构,物质的立体结构和氨气分子相同,说明该分子也是三角锥形结构,
A.水分子中O原子价层电子对个数=2+1212×(6-2×1)=4且含有2个孤电子对,所以水分子为V形,故A错误;
B.水合氢离子中O原子价层电子对个数=3+1212×(6-1-3×1)=4且含有一个孤电子对,所以为三角锥形结构,故B正确;
C.甲烷分子中C原子价层电子对个数=4+1212×(4-4×1)=4且不含孤电子对,所以甲烷分子为正四面体结构,故C错误;
D.二氧化碳分子中C原子和每个O原子形成共价双键,且不含孤电子对,所以二氧化碳分子为直线形分子,故D错误;
故选B.
点评 本题考查了分子空间构型的判断,根据价层电子对互斥理论来分析解答即可,注意孤电子对的计算方法,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.下列各组顺序的排列不正确的是( )
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO4<H2CO3<H2SO4 | D. | 熔点:NaCl>Na>CO2 |
16.某同学设计了如下实验测量m g铜银合金样品中铜的质量分数:
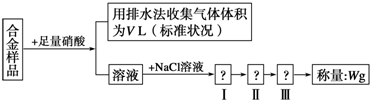
下列说法中不正确的是( )

下列说法中不正确的是( )
| A. | 合金的熔点比其成分金属低,通常比成分金属具有更优良的金属特性 | |
| B. | 铜银都能与稀硝酸反应,收集到的V L气体可能全为NO | |
| C. | 操作Ⅰ是过滤,操作Ⅱ是洗涤,操作Ⅲ应是烘干 | |
| D. | 根据反应收集到的气体体积可以计算铜和银的质量分数 |
13.高温超导体中铊(81Tl)是有效成分之一,已知铊是铝的同族元素.下列关于铊的描述不正确的是( )
| A. | 铊不是半导体材料 | B. | 铊能形成+3价的化合物 | ||
| C. | Tl(OH)3与Al(OH)3一样,具有两性 | D. | 铊能与稀盐酸反应 |
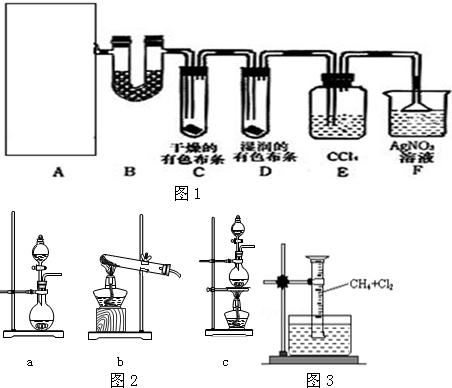
10.北京奥运会“祥云”火炬所用燃料的主要成分是丙烷,下列有关丙烷的叙述错误的是( )
| A. | 分子中的3个碳原子在一条直线上 | |
| B. | 在光照条件下能和氯气发生取代反应 | |
| C. | 分子中含有极性键和非极性键 | |
| D. | 丙烷和丁烷互为同系物 |
17.有关2SO2+O2催化剂_△催化剂–––––––△2SO3的说法中,不正确的是( )
| A. | 该反应为可逆反应,故在一定条件下SO2和O2不可能全部转化为SO3 | |
| B. | 达到平衡后,反应就停止了,故正、逆反应速率相等且均为零 | |
| C. | 一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻之后,正、逆反应速率相等 | |
| D. | 平衡时SO2、O2、SO3的分子数之比不再改变 |
14.结晶玫瑰是具有强烈玫瑰香气的香料,化学式为C10H9O2Cl3.它属于( )
| A. | 无机物 | B. | 有机物 | C. | 单质 | D. | 混合物 |
 碳酸钠是一种重要的化工产品,一种工业生产流程如图所示.
碳酸钠是一种重要的化工产品,一种工业生产流程如图所示.