题目内容
8.下列各组物质混合后,不能生成NaOH的是( )| A. | Na和H2O | B. | NaCl和H2O | ||
| C. | Na2O2和H2O | D. | Na2CO3溶液和Ca(OH)2溶液 |
分析 A.钠与水反应生成氢氧化钠和氢气;
B.氯化钠和水不反应;
C.过氧化钠与水反应生成氢氧化钠和氧气;
D.碳酸钠与氢氧化钙反应生成碳酸钙和氢氧化钠.
解答 解:A.钠与水反应生成氢氧化钠和氢气,能够生成氢氧化钠,故A不选;
B.氯化钠和水不反应,不能生成氢氧化钠,故B选;
C.过氧化钠与水反应生成氢氧化钠和氧气,能够生成氢氧化钠,故C不选;
D.碳酸钠与氢氧化钙反应生成碳酸钙和氢氧化钠,能够生成氢氧化钠,故D不选;
故选:B.
点评 本题考查了元素化合物知识,熟悉钠及其化合物性质是解题关键,题目难度不大.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
18.下了物质中不属于有机物的是( )
| A. | 乙醇 | B. | 乙酸 | C. | 乙炔 | D. | 碳化硅 |
19.二氧化硫是污染大气形成酸雨的主要有害物质之一,如果了解二氧化硫的性质,它在我们的生活中也有广泛的用途.
(1)下列可产生二氧化硫污染大气的是A、B、C、D.(填序号).
A.含硫矿石的冶炼 B.大量化石燃料的燃烧
C.大量烟花爆竹的燃放 D.硫酸厂排放的工业尾气
(2)某课外小组采集了一份雨水样品,每隔一段时间测定该雨水样品的pH变化数据如下
分析雨水样品pH变化的原因(用文字和化学方程式说明)因在空气中亚硫酸与氧气反应生成酸性更强的硫酸,所以pH变小,2H2SO3+O2═2H2SO4
(3)某实验小组欲探究二氧化硫的化学性质,设计如下实验,请完成实验报告.
(1)下列可产生二氧化硫污染大气的是A、B、C、D.(填序号).
A.含硫矿石的冶炼 B.大量化石燃料的燃烧
C.大量烟花爆竹的燃放 D.硫酸厂排放的工业尾气
(2)某课外小组采集了一份雨水样品,每隔一段时间测定该雨水样品的pH变化数据如下
| 测试时间段 | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
(3)某实验小组欲探究二氧化硫的化学性质,设计如下实验,请完成实验报告.
| 序号 | 二氧化硫的性质 | 主要操作和现象 | 化学方程式 |
| ① | 将二氧化硫通入装有品红溶液的 试管中,品红由红色变为无色 | ||
| ② | 将二氧化硫与硫化氢气体混合,出现 黄色固体. | SO2+2H2S=3S+2H2O | |
| ③ | 将二氧化硫通入装有新制氯水的试管中,氯水由浅黄绿色变为无色 |
16.某同学设计了如下实验测量m g铜银合金样品中铜的质量分数:
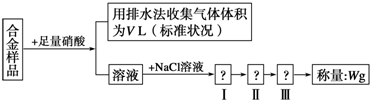
下列说法中不正确的是( )

下列说法中不正确的是( )
| A. | 合金的熔点比其成分金属低,通常比成分金属具有更优良的金属特性 | |
| B. | 铜银都能与稀硝酸反应,收集到的V L气体可能全为NO | |
| C. | 操作Ⅰ是过滤,操作Ⅱ是洗涤,操作Ⅲ应是烘干 | |
| D. | 根据反应收集到的气体体积可以计算铜和银的质量分数 |
13.高温超导体中铊(81Tl)是有效成分之一,已知铊是铝的同族元素.下列关于铊的描述不正确的是( )
| A. | 铊不是半导体材料 | B. | 铊能形成+3价的化合物 | ||
| C. | Tl(OH)3与Al(OH)3一样,具有两性 | D. | 铊能与稀盐酸反应 |
17.有关2SO2+O2$\frac{\underline{\;催化剂\;}}{△}$2SO3的说法中,不正确的是( )
| A. | 该反应为可逆反应,故在一定条件下SO2和O2不可能全部转化为SO3 | |
| B. | 达到平衡后,反应就停止了,故正、逆反应速率相等且均为零 | |
| C. | 一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻之后,正、逆反应速率相等 | |
| D. | 平衡时SO2、O2、SO3的分子数之比不再改变 |
18.下列符合泡利不相容原理的是( )
| A. | 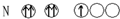 | B. |  | C. |  | D. | 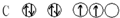 |
 碳酸钠是一种重要的化工产品,一种工业生产流程如图所示.
碳酸钠是一种重要的化工产品,一种工业生产流程如图所示.