题目内容
15.已知外电路中,电子由铜流向a极.有关图所示的装置分析合理一项是( )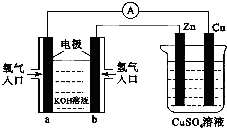
| A. | 该装置中Cu极为正极 | |
| B. | 当铜极的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L | |
| C. | b极反应的电极反应式为:H2-2e-═2H+ | |
| D. | 一段时间后锌片质量减少 |
分析 根据图知,左边装置在燃料电池,通入燃料氢气的电极b是负极、a是正极,电解质溶液呈碱性,则负极反应式为H2-2e-+2OH-=2H2O、正极反应式为O2+2H2O+4e-=4OH-;右边装置是电解池,Zn是阴极、Cu是阳极,相当于电镀池,阳极上电极反应式为Cu-2e-=Cu2+、阴极电极反应式为Cu2++2e-=Cu,据此分析解答.
解答 解:根据图知,左边装置在燃料电池,通入燃料氢气的电极b是负极、a是正极,电解质溶液呈碱性,则负极反应式为H2-2e-+2OH-=2H2O、正极反应式为O2+2H2O+4e-=4OH-;右边装置是电解池,Zn是阴极、Cu是阳极,相当于电镀池,阳极上电极反应式为Cu-2e-=Cu2+、阴极电极反应式为Cu2++2e-=Cu,
A.通过以上分析知,Cu是阳极,故A错误;
B.当铜电极消耗12.8g时,n(Cu)=$\frac{12.8g}{64g/mol}$=0.2mol,转移电子物质的量=0.2mol×2=0.4mol,根据转移电子守恒得消耗氧气体积=$\frac{0.4mol}{4}×22.4L/mol$=2.24L,故B正确;
C.电解质溶液呈碱性,所以b电极反应式为H2-2e-+2OH-=2H2O,故C错误;
D.锌作阴极被保护,锌电极上铜离子得电子生成Cu,所以锌片质量增加,故D错误;
故选B.
点评 本题考查原电池和电解池原理,为高频考点,明确原电池和电解池判断方法及各个电极上发生的反应是解本题关键,难点是电极反应式的书写,易错选项是C,注意碱性条件下不能生成氢离子.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.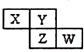 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A. | Z的离子半径小于Y的离子半径 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Z的非金属性比Y的强 | |
| D. | X与Y形成的化合物都易溶于水 |
6.下列装置或操作能达到实验目的是( )
| A. | 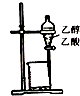 除去乙醇中的乙酸 | B. | 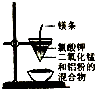 制取少量金属锰 | ||
| C. | 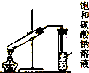 制取乙酸乙酯 | D. | 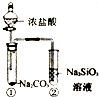 证明酸性:盐酸>碳酸>硅酸 |
3.下列图示与对应的叙述相符的是( )
| A. | 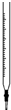 图为碱式滴定管,可盛装NaOH、KMnO4等溶液,不可盛装酸性液体 | |
| B. | 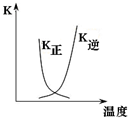 图中曲线表示反应2A(g)+B(g)═2C(g)△H>0,正、逆反应的平衡常数K随温度的变化 | |
| C. | 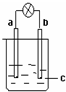 图中如果a是铁,b是碳,c是氯化铜溶液,则电流计指针偏转,且a变粗,b变细 | |
| D. | 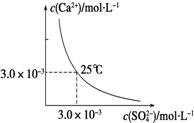 图表示25℃时,CaSO4在水中的沉淀溶解平衡曲线.向100 mL该条件下的CaSO4饱和溶液中加入100 mL 0.01mol•L-1的Na2SO4溶液有沉淀析出 |
20.NaH与水反应的化学方程式为NaH+H2O═NaOH+H2↑,在该反应中NaH( )
| A. | 是氧化剂 | B. | 是还原剂 | ||
| C. | 既是氧化剂又是还原剂 | D. | 既不是氧化剂又不是还原剂 |
7.在标准状况下,在三个干燥的烧瓶内分别装入:纯净的NH3,含有少量空气的NH3,NO2和O2的混合气体[v(NO2):v(O2)=4:1].然后分别做喷泉实验,三个烧瓶中所得溶液的物质的量浓度之比为( )
| A. | 21:12:4 | B. | 5:5:4 | C. | 5:5:1 | D. | 无法确定 |
4.下列仪器的使用或操作或实验正确的是( )
| A. | 测定溶液pH的操作:将pH试纸置于表面皿上,用蒸馏水润湿,再用洁净玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡比较 | |
| B. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| C. | 测定空气中甲醛含量,使50mL注射器充满空气,通入到2mL2×10-4mol/L用硫酸酸化的高锰酸钾溶液中,重复前面的操作直到紫红色褪去,记录消耗空气体积,即可粗略测定空气中甲醛含量 | |
| D. | 做Al与CuSO4溶液的置换反应实验时,可将铝条直接插入CuSO4溶液中,观察铝片表面是否有铜析出 |
5.下列物质间的反应能用H++OH-═H2O表示的是( )
| A. | 醋酸和氢氧化钠 | B. | 盐酸和氨水 | ||
| C. | 硫酸和氢氧化钾 | D. | 碳酸氢钠和氢氧化钠 |
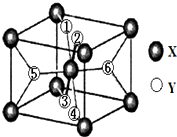 在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物.氢化物晶体的结构有共价型和离子型之分.
在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物.氢化物晶体的结构有共价型和离子型之分.