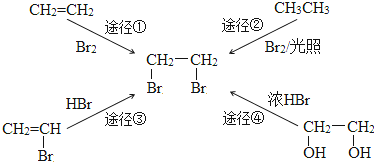
题目内容
11.向Ba(OH)2溶液中逐滴加入NaHSO4溶液至恰好不再生成沉淀时为止,请写出发生反应的离子方程式Ba2++OH-+H++SO42-=BaSO4↓+H2O,在以上溶液中继续滴加NaHSO4溶液,请写出此步反应的离子方程式:OH-+H+=H2O.分析 Ba(OH)2溶液中,逐滴加入NaHSO4溶液,硫酸氢钠少量全反应,氢氧根应剩余,溶液是碱性的,继续滴加NaHSO4溶液发生氢离子与氢氧根离子的反应,据此解答.
解答 解:向Ba(OH)2溶液中,逐滴加入NaHSO4溶液,硫酸氢钠相对于氢氧化钡量少,所以硫酸氢钠全反应,即Ba2++OH-+H++SO42-=BaSO4↓+H2O;
溶液中剩余氢氧根离子,在以上溶液中继续滴加NaHSO4溶液,发生氢离子与氢氧根离子的反应,离子方程式为:OH-+H+=H2O;
故答案为:Ba2++OH-+H++SO42-=BaSO4↓+H2O;OH-+H+=H2O.
点评 本题考查了离子方程式的书写,侧重考查反应物用量不同的离子反应,明确反应实质是解题关键,题目难度不大.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目
1.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 58 g乙烯和乙烷的混合气体中碳原子数目一定为4NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 142g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA | |
| D. | 已知3BrF3+5H2O=HBrO3+Br2+9HF+O2↑ 如果有5mol H2O参加氧化还原反应,则由水还原的BrF3分子数目为3NA |
2.某同学组装了如图所示的电化学装置,则下列说法正确的是( )
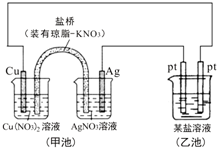

| A. | 图中甲池为原电池装置,Cu电极发生还原反应 | |
| B. | 实验过程中,甲池左侧烧杯中NO3-的浓度不变 | |
| C. | 若甲池中Ag电极质量增加5.4g时,乙池某电极析出1.6g金属,则乙中的某盐溶液可能是AgNO3溶液 | |
| D. | 若用铜制U形物代替“盐桥”,工作一段时间后取出U形物称量,质量会减小 |
19.H、C、N、O、Al、Fe是六种常见元素
(1)Fe位于周期表第四周期,第VIII族,其基态原子未成对电子数为4.碳的同素异形体中,金刚石熔点比C60高(填“高”、“低”).
(2)用“>”或“<”填空:
(3)Al能将污水中NO3-转化为N2,同时铝的反应产物还能净化污水,该反应的离子方程式10Al+6NO3-+18H2O=3N2↑+10Al(OH)3+6OH-;其中产生的铝的化合物能净水的原理是生成的Al(OH)3胶体具有吸附作用.
(4)已知2H2(g)+O2(g)=2H2O(l)△H=-571.66kJ•mol-1
CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1306.42kJ•mol-1
写出利用CO2和H2合成(CH2=CH2)的热化学方程式为2CO2(g)+6H2(g)═CH2=CH2(g)+4H2O(l)△H=-408.56kJ•mol-1.
(1)Fe位于周期表第四周期,第VIII族,其基态原子未成对电子数为4.碳的同素异形体中,金刚石熔点比C60高(填“高”、“低”).
(2)用“>”或“<”填空:
| 离子半径 | 电负性 | 第一电离能 | 沸点 |
| O2->Al3+ | C<N | N>O | CH4< NH3 |
(4)已知2H2(g)+O2(g)=2H2O(l)△H=-571.66kJ•mol-1
CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1306.42kJ•mol-1
写出利用CO2和H2合成(CH2=CH2)的热化学方程式为2CO2(g)+6H2(g)═CH2=CH2(g)+4H2O(l)△H=-408.56kJ•mol-1.
6.下列各晶体中任意一个原子都被相邻的4个原子所包围:以共价键结合成正四面体结构,并向空间伸展成网状结构的是( )
| A. | 甲烷 | B. | 石墨 | C. | 晶体硅 | D. | 水晶 |
16.中国环境监测总站数据显示,PM2.5、SO2、NOx等是连续雾霾过程影响空气质量显著的污染物,其主要来源为燃煤、机动车尾气等.因此,对它们进行研究具有重要意义.请回答:
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据计算PM2.5待测试样的pH=4.
(2)NOx是汽车尾气的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:
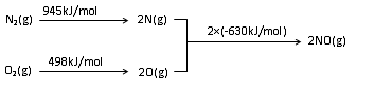
N2(g)+O2(g)?2NO (g)△H=+183kJ/mol.
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度(mol/L) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)NOx是汽车尾气的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:

N2(g)+O2(g)?2NO (g)△H=+183kJ/mol.
3.电解NO制备NH4NO3,其工作原理如图所示,下列说法不正确的是( )
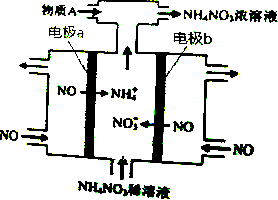

| A. | b极的电极反应为:NO-3e-+4OH-=NO${\;}_{3}^{-}$+2H2O | |
| B. | 溶液中的H+由电极b处向电极a处迁移 | |
| C. | 电解过程总反应的化学方程式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3 | |
| D. | 为使电解产物全部转化为NH4NO3,需补充的物质A是NH3 |