题目内容
19.H、C、N、O、Al、Fe是六种常见元素(1)Fe位于周期表第四周期,第VIII族,其基态原子未成对电子数为4.碳的同素异形体中,金刚石熔点比C60高(填“高”、“低”).
(2)用“>”或“<”填空:
| 离子半径 | 电负性 | 第一电离能 | 沸点 |
| O2->Al3+ | C<N | N>O | CH4< NH3 |
(4)已知2H2(g)+O2(g)=2H2O(l)△H=-571.66kJ•mol-1
CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1306.42kJ•mol-1
写出利用CO2和H2合成(CH2=CH2)的热化学方程式为2CO2(g)+6H2(g)═CH2=CH2(g)+4H2O(l)△H=-408.56kJ•mol-1.
分析 (1)根据Fe元素位于周期表第四周期第 VIII族,其基态原子价电子的排布式为3d64S2判断未成对电子数;根据金刚石是原子晶体,C60是分子晶体,判断熔点高低;
(2)根据核外电子排布相同的离子,核电荷数越大,离子半径越小判断;
根据同一周期元素,电负性随着原子序数的增大而增大判断;
根据N基态原子的价电子排布式为2s22p3处于半充满的稳定结构第一电离能大判断;
根据NH3和CH4都属于分子晶体,NH3分子间存在氢键,沸点高判断.
(3)Al能将污水中NO3-转化为N2,同时铝的反应产物还能净化污水,该反应的离子方程式10Al+6NO3-+18H2O=3N2↑+10Al(OH)3+6OH-,其中产生的铝的化合物能净水的原理是生成的Al(OH)3胶体具有吸附作用.
(4)根据盖斯定律①2H2(g)+O2(g)=2H2O(l)△H=-571.66kJ•mol-1
②CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1306.42kJ•mol-1
则CO2和H2合成(CH2=CH2)的热化学方程式为①×3-②得该热化学方程式,据此计算焓变;
解答 解:(1)Fe元素位于周期表第四周期第VIII族,价电子的排布式为3d64S2,所以其基态原子未成对电子数为4,因为金刚石是原子晶体,C60是分子晶体,故金刚石熔点比C60高,故答案为:四;VIII;4;高;
(2)核外电子排布相同的离子,核电荷数越大,离子半径越小,所以离子半径:O2->Al3+;同一周期元素,电负性随着原子序数的增大而增大,故电负性C<N;因为N基态原子的价电子排布式为2s22p3处于半充满的稳定结构,O基态原子的价电子排布式为2s22p4,O原子比N原子更容易失去第一个电子,故第一电离能N>O;NH3和CH4都属于分子晶体,NH3分子间存在氢键,故沸点CH4<NH3,故答案为:>;<;>;<;
(3)Al能将污水中NO3-转化为N2,同时铝的反应产物还能净化污水,该反应的离子方程式10Al+6NO3-+18H2O=3N2↑+10Al(OH)3+6OH-,其中产生的铝的化合物能净水的原理是生成的Al(OH)3胶体具有吸附作用,
故答案为:10Al+6NO3-+18H2O=3N2↑+10Al(OH)3+6OH-;生成的Al(OH)3胶体具有吸附作用;
(4)①2H2(g)+O2(g)=2H2O(l)△H=-571.66kJ•mol-1
②CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1306.42kJ•mol-1
则CO2和H2合成(CH2=CH2)的热化学方程式为①×3-②得:2CO2(g)+6 H2(g)═CH2=CH2(g)+4H2O(l)△H=(-571.66×3+1306.42)kJ•mol-1=-408.56kJ•mol-1,故答案为:2CO2(g)+6 H2(g)═CH2=CH2(g)+4H2O(l)△H=-408.56kJ•mol-1.
点评 本题考查了元素周期表以及元素周期律的应用,以此为载体,考查了盖斯定律、熔沸点的比较、电负性、第一电离能以及铝的净水等,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | NH4Cl→NH3↑+HCl↑ | B. | NH3+CO2+H2O→NH4HCO3 | ||
| C. | 2NaOH+Cl2→NaCl+NaClO+H2O | D. | 2Na2O2+2CO2→2Na2CO3+O2 |

| A. | 分子中含有2个手性碳原子 | |
| B. | 能发生氧化、取代、加成反应 | |
| C. | 1 mol该化合物与足量浓溴水反应,最多消耗3 mol Br2 | |
| D. | 1 mol该化合物与足量NaOH溶液反应,最多消耗4 mol NaOH |
| A. | 24种 | B. | 16种 | C. | 12种 | D. | 8种 |
 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解(1)卤族元素位于周期表的p区,溴的价电子排布式为4s24p5
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在,使分子缔合的作用力是氢键
(3)根据表中提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是I
| 氯 | 氧 | 溴 | 碘 | 镀 | |
| 第一电离能(kj/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
 )和HIO4,前者为五元酸,后者为一元酸,请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸,请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)(5)已知ClO2为角型结构,中心氯原子周围有四对价层电子,ClO2-中心氯原子的杂化轨道类型为sp3
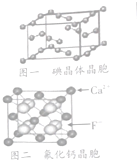
(6)图一为碘晶体晶胞结构,有关说法中正确的是AD(填答案选项的序号)
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以配位数4交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.硫晶体为无线延伸的空间结构,是原子晶体
D.碘晶体中微粒间存在非极性键和范德华力
(7)已知CaF2晶胞如图二所示,晶体的密度为pg/cm3,NA为阿伏伽德罗常数,相邻最近的两个Ca2+的核间距为acm,则CaF2的相对分子质量可以表示为$\frac{{a}^{3}ρ{N}_{A}}{4}$.
| A | A的一种单质在自然界中硬度最大 |
| B | B元素的第一电离能比同周期相邻两个元素都大 |
| C | 同周期中,C元素的最高价氧化物对应的水化物的碱性最强 |
| D | D的基态原子M层电子数是K层的2 倍 |
| E | E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满 |
(2)A、B、D三种元素电负性由大到小排列顺序为N>C>Si,其中A的最高价氯化物为非极性分子.(填“极性分子”或“非极性分子”)
(3)A和B的最简单氢化物中沸点较高的NH3.原因是NH3分子间存在氢键.
(4)已知:
①AH4(g)+2BO2(g)=B2(g)+AO2(g)+2H2O(g) H1=-867kJ•mol-1
②2BO2(g)=B2 O4(g) H2=-56.9kJ•mol-1
写出AH4和B2O4反应的热化学方程式CH4(g)+N2O4(g)═N2(g)+CO2(g)+2H2O(g)△H=-810.1kJ/mol.
| A. | 按系统命名法,化合物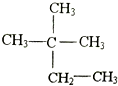 的名称为2-甲基-2-乙基丙烷 的名称为2-甲基-2-乙基丙烷 | |
| B. | 分别向皂化反应完成后的溶液、豆浆、牛奶中加入浓食盐水都有固体析出 | |
| C. | 碳原子数小于5的烷烃共有4种,他们之间互为同系物 | |
| D. | 石油裂解可以得到乙烯,煤干馏得到的煤焦油中可以提取苯,乙烯和苯使溴水褪色的原理相同 |
| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.160 | 0.186 | 0.102 | 0.143 | 0.074 |
| 主要化合价 | +2 | +1 | -2,+4,+6 | +3 | -2 |
| A. | 离子的还原性:T2->Z2- | |
| B. | 离子半径:T2->X2+ | |
| C. | 元素最高价氧化物对应水化物的碱性:Y>R>X | |
| D. | 形成氢化物的沸点:Z>T |