题目内容
2.“绿色化学”的核心理念是:原子经济性原则.即力求反应物分子中的所有原子全都转化到目标产物中,理想状态的原子利用率为100%.在合成1,2-二溴乙烷时,原子利用率最高的途径是( )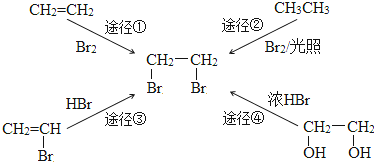
| A. | 途径① | B. | 途径② | C. | 途径③ | D. | 途径④ |
分析 根据题中信息“绿色化学”工艺的要求:反应物全部转化为期望的产物,使原子的利用率达到100%,可知反应只生成一种生成物,以此解答该题.
解答 解;A.途径①为加成反应,反应物全部转化为生成物,原子利用率为100%.故A正确;
B.途径②为取代反应,可生成多种溴代烃,产量较低,故B错误;
C.途径③为加成反应,可生成CH3CHBr2,产物不唯一,故C错误;
D.途径④有水生成,原子利用率较低,故D错误.
故选A.
点评 本题考查有机物的结构和性质,主要考查了绿色化学的概念,掌握反应中产物的种类与原子利用率100%的关系是解答的关键,题目难度不大.

练习册系列答案
相关题目
13.温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g)?PCl3(g)+Cl2(g)通过一段时间后达到平衡.反应过程中测定的部分数据见下表.下列说法正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在 前50s的平均速率v(PCl5)=0.0032mol.L-1.s-1 | |
| B. | 保持其它条件不变,升高温度,平衡时c(PCl5)=0.11mol.L-1,则该反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2反应达到平衡前v正>v逆 | |
| D. | 相同温度下,起始时向容器中充入2.0molPCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80% |
10.几种短周期元素的原子半径及主要化合价见下表:
根据表中信息,判断以下说法正确的是( )
| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.160 | 0.186 | 0.102 | 0.143 | 0.074 |
| 主要化合价 | +2 | +1 | -2,+4,+6 | +3 | -2 |
| A. | 离子的还原性:T2->Z2- | |
| B. | 离子半径:T2->X2+ | |
| C. | 元素最高价氧化物对应水化物的碱性:Y>R>X | |
| D. | 形成氢化物的沸点:Z>T |
7.下列离子方程式书写正确的是( )
| A. | 石炭酸与NaOH溶液混合:H++OH-→H2O | |
| B. | 稀HNO3洗涤试管中的银镜:Ag+NO3-+2H+═Ag++NO↑+H2O | |
| C. | 乙烯使酸性KMnO4褪色:5C2H4+12MnO4-+36H+→12Mn2++10CO2↑+28H2O | |
| D. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热: |
14.下列装置应用于实验室制取氯气并回收氯化锰溶液,不能达到实验目的是( )
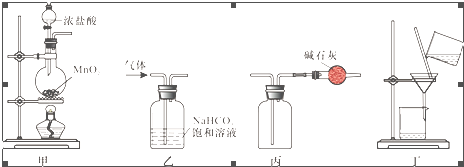

| A. | 用装置甲制取氯气 | |
| B. | 用装置乙除去氯气中的少量氯化氢 | |
| C. | 用装置丙收集氯气并防止污染空气 | |
| D. | 用装置丁分离二氧化锰和氯化锰溶液 |
 +2HNO3$→_{100-110℃}^{浓硫酸}$
+2HNO3$→_{100-110℃}^{浓硫酸}$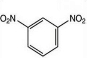 +2H2O.
+2H2O. 与NaOH水溶液共热,生成的有机物的结构简式为
与NaOH水溶液共热,生成的有机物的结构简式为 ;
; ;若该有机物有一个反式异构体,且能与氢气加成生成2-甲基戊烷,则该有机物的结构简式为
;若该有机物有一个反式异构体,且能与氢气加成生成2-甲基戊烷,则该有机物的结构简式为 ;
;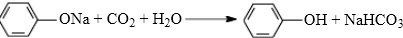 .
.