题目内容
9.10mL浓度为1mol•L-1的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成量的是( )| A. | K2SO4 | B. | CH3COONa | C. | CuSO4 | D. | Na2CO3 |
分析 为了减缓反应进行的速率,加入溶液后应降低氢离子浓度,但又不影响生成氢气的总量,则提供的氢离子的总物质的量不变,而C选项中构成原电池,加快反应速率,D选项中碳酸钠反应消耗氢离子,生成氢气的总量减少.
解答 解:A.加入K2SO4溶液,相当于加水稀释,溶液中氢离子浓度降低,且氢离子总量不变,故能减慢反应速率且又不影响氢气生成量,故A正确;
B,加入CH3COONa溶液,溶液被稀释,且醋酸根与溶液中氢离子结合为醋酸分子,溶液中氢离子浓度降低,且提供的氢离子总量不变,故能减慢反应速率且又不影响氢气生成量,故B正确;
C.Zn可以置换出Cu,构成原电池,加快反应速率,故C错误;
D.加入碳酸钠溶液,与盐酸反应是二氧化碳,氢离子总量较小,生成氢气的量减少,故D错误,
故选:AB.
点评 本题考查化学反应速率影响因素,比较基础,需注意生成氢气的量不变,注意C选项构成原电池,加快反应速率.

练习册系列答案
相关题目
19.下列实验装置设计正确、且能达到目的是( )
| 编号 | A | B | C | D |
| 实验 方案 | 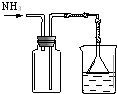 |  | 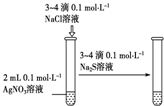 |  置于光亮处 |
| 实验 目的 | 收集氨气及并进行 尾气吸收 | 制取乙炔并验证炔烃 的性质 | 验证AgCl沉淀可转化为 溶解度更小的Ag2S沉淀 | 验证甲烷与氯气发生化学反应 |
| A. | A | B. | B | C. | C | D. | D |
20.关于HOOC-CH═CH-CH2OH,下列说法不正确的是( )
| A. | 分子式为C4H6O3,每摩尔该物质充分燃烧需消耗4mol O2 | |
| B. | 能发生取代、加成、氧化、加聚、中和等反应 | |
| C. | 分别与足量Na、NaOH、Na2CO3反应,生成物均为NaOOC-CH═CH-CH2OH | |
| D. | 该分子含有两种官能团 |
17.无水氯化铝在生产、生活中应用广泛.
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为Al3++3H2O?Al(OH)3+3H+.
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
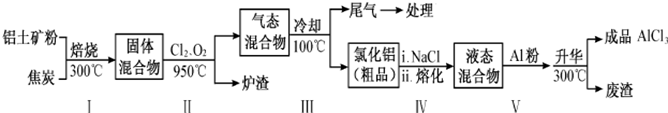
已知:
①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是防止后续步骤生成的AlCl3水解或增大反应物的接触面积,加快反应速率(只要求写出一种).
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是Fe或铁.
③已知:
Al2O3(s)+3C(s)=2Al(s)+3CO(g)△H1=+1344.1kJ•mol-1
2AlCl3(g)=2Al(s)+3Cl2(g)△H2=+1169.2kJ•mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为Al2O3(s)+3C(s)+3Cl2(g)=2AlCl3(g))+3CO(g)△H=+174.9KJ/mol.
④步骤Ⅲ的经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为NaCl、NaClO、Na2CO3 .
⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是除去FeCl3,提高AlCl3纯度.
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为Al3++3H2O?Al(OH)3+3H+.
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:

已知:
| 物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 |
| 沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 |
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是Fe或铁.
③已知:
Al2O3(s)+3C(s)=2Al(s)+3CO(g)△H1=+1344.1kJ•mol-1
2AlCl3(g)=2Al(s)+3Cl2(g)△H2=+1169.2kJ•mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为Al2O3(s)+3C(s)+3Cl2(g)=2AlCl3(g))+3CO(g)△H=+174.9KJ/mol.
④步骤Ⅲ的经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为NaCl、NaClO、Na2CO3 .
⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是除去FeCl3,提高AlCl3纯度.
4.下列离子中半径最大的是( )
| A. | Na+ | B. | Mg2+ | C. | O2- | D. | F- |
1.下列有关海水综合利用的说法正确的是( )
| A. | 电解饱和食盐水可制得金属钠 | B. | 海带提碘只涉及物理变化 | ||
| C. | 海水提溴涉及到氧化还原反应 | D. | 海水提镁涉及到复分解反应 |
18.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
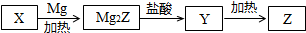
10.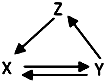 如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
 如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )| X | Y | Z | |
| ① | SiO2 | H2SiO3 | Na2SiO3 |
| ② | CH3CH2OH | CH3CHO | CH2=CH2 |
| ③ | AlCl3 | Al(OH)3 | Al2O3 |
| ④ | NO | NO2 | HNO3 |
| ⑤ | FeCl2 | Fe | FeCl3 |
| A. | ③④⑤ | B. | ②③④ | C. | ④⑤ | D. | ①②⑤ |
 .
.