题目内容
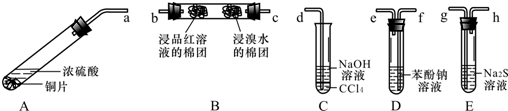
8.下列实验操作或装置正确的是( )| A. | 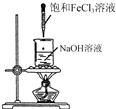 利用图所示操作制备氢氧化铁胶体 | |
| B. |  利用图所示装置制取NH3 | |
| C. | 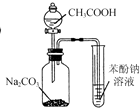 利用图所示装置证明H2CO3酸性强于苯酚 | |
| D. |  利用图所示装置制备乙酸乙酯 |
分析 A.氢氧化钠溶液中加入氯化铁溶液生成沉淀;
B.实验室用氯化铵和氢氧化钙加热制取氨气,且采用向下排空气法收集;
C.乙酸具有挥发性,生成的二氧化碳中含有乙酸而干扰实验;
D.制取乙酸乙酯用饱和碳酸钠处理乙酸、乙醇.
解答 解:A.氢氧化钠溶液中加入氯化铁溶液生成沉淀,故A错误;
B.实验室用氯化铵和氢氧化钙加热制取氨气,氨气常温下和氧气不反应且密度小于空气,所以采用向下排空气法收集,故B正确;
C.乙酸具有挥发性,生成的二氧化碳中含有乙酸,乙酸也和苯酚钠反应生成苯酚,从而干扰实验,应该在盛放苯酚钠的仪器前有一个洗气装置,故C错误;
D.氢氧化钠能将乙酸乙酯水解,应该用饱和的碳酸钠处理乙酸、乙醇,乙醇易溶于水,乙酸能和碳酸钠反应生成可溶性的乙酸钠,饱和碳酸钠能降低乙酸乙酯溶解度,故D错误;
故选B.
点评 本题考查化学实验方案评价,涉及气体的制备、物质的制备、酸性强弱判断等知识点,为高考高频点,明确实验原理是解本题关键,注意D中饱和碳酸钠的作用,题目难度不大.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
19. 某反应由两步反应A═B═C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A═B═C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
 某反应由两步反应A═B═C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A═B═C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )| A. | A═B的反应热△H=+(E2-E1)KJ/mol | B. | 三种化合物中C最稳定 | ||
| C. | C═B 是放热反应 | D. | 整个反应中△H=E1-E4 |
3.常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水].下列有关说法不正确的是( )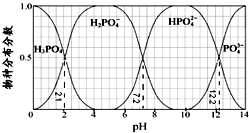

| A. | H3PO4的Ka3=10-12.2,HPO42-的水解平衡常数为10-6.8 | |
| B. | Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性 | |
| C. | 为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右 | |
| D. | pH=13时,溶液中各微粒浓度大小关系为:c(Na+)>c(HPO42-)>c(PO43-)>c(OH-)>c(H+) |
13.分子式为C6H14O的醇中,有些醇能被氧化成相应的酸,这些醇与相应的酸重新组合可形成的脂共有( )
| A. | 16种 | B. | 25种 | C. | 36种 | D. | 64种 |
17.常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol•L-1NaOH溶液.整个实验过程中溶液的pH变化曲线如右图所示,不考虑次氯酸分解,下列叙述正确的是( )
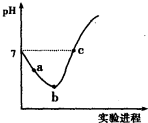

| A. | 实验过程中用pH试纸测定溶液的pH | |
| B. | a~b段,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| C. | b点对应溶液中:c(Cl-)>c(H+)>c(HClO)>c(ClO-)>c(OH-) | |
| D. | c点对应溶液中:c(Na+)=2c(ClO-)+c(HClO) |

 .
. .
. .
.
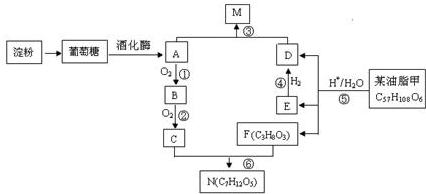
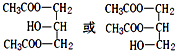 ;C与F按不同的比例,还可以生成另外两种物质X、Y,且相对分子量X<N<Y,则Y的分子式C9H14O6.
;C与F按不同的比例,还可以生成另外两种物质X、Y,且相对分子量X<N<Y,则Y的分子式C9H14O6. C17H35COOCH2CH3+H2O.
C17H35COOCH2CH3+H2O.