题目内容
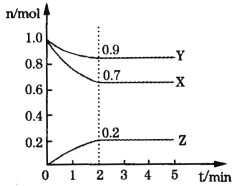
【题目】某温度下,在2L容器中发生反应,A、B、C物质的量随时间变化的曲线如图所示。下列叙述中正确的是
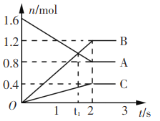
A.该反应的化学方程式为2A![]() B+3C
B+3C
B.反应开始至2s时,A的平均反应速率为0.4 mol(/L·s)
C.t1时刻,该反应达到化学平衡状态
D.反应开始至1s时,生成C的物质的量大于0.2 mol
【答案】D
【解析】
由图像可知,A为反应物,B、C为生成物,在2s内,A的量变化了0.8mol,B的量变化了1.2mol,C的量变化了0.4mol,根据反应系数之比与物质变化量之比相等可知,反应方程为2A![]() 3B+C,据此回答问题。
3B+C,据此回答问题。
A. 该反应的化学方程式为2A![]() 3B+C,A错误;
3B+C,A错误;
B. 反应开始至2s时,A的平均反应速率为![]() mol(/L·s),B错误;
mol(/L·s),B错误;
C. t1时刻,各量还在发生变化,反应还在进行,没有达到平衡状态;t2时刻,各物质的量不变,该反应达到化学平衡状态,C错误;
D. 反应开始至1s时,A的浓度大,正反应速率快,生成C的物质的量大于0.2 mol,D正确。
答案为D。

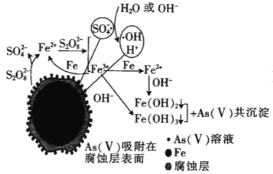
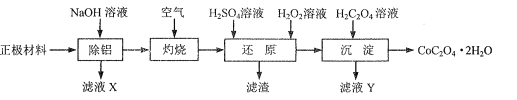
【题目】2019年诺贝尔化学奖授予锂离子电池的发明者,LiFePO4是锂离子电池的正极材料。用含锂废渣(主要金属元素的含量:Li 8.50%、Ni 6.55%、Mg 13.24%)制备Li2C2O4,并用其制备LiFePO4部分工艺流程如图(该流程可能造成水体砷污染):
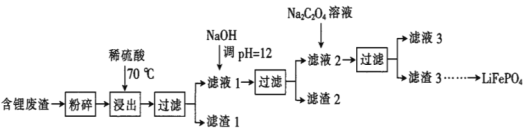
已知:滤液1、滤液2中部分离子的浓度(g·L-1):
Li+ | Ni2+ | Mg2+ | |
滤液1 | 22.72 | 20.68 | 60.18 |
滤液2 | 21.94 | 7.7×10-3 | 0.78×10-3 |
I.制备Li2C2O4
(1)滤渣2的主要成分有__(填化学式)。
(2)Na2C2O4溶液中各离子的浓度由大到小顺序为__。
(3)写出加入Na2C2O4溶液时发生反应的离子方程式:__。
Ⅱ.制备LiFePO4
(4)将电池极Li2C2O4和FePO4置于高温下反应生成LiFePO4和一种温室气体,该反应的化学方程式是___。
(5)LiFePO4需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是__(任写一点)。
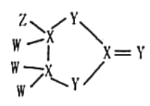
(6)我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的As(Ⅴ),其机制模型如图,其中零价铁与过硫酸钠反应的离子方程式是__。在该模型中得到的铁砷共沉淀物经灼烧(无元素化合价变化)后得到一种磁性化合物,化学式为Fe7As2O14,该物质中二价铁与三价铁的个数比为__。