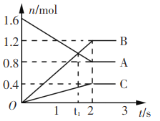
题目内容
【题目】粉煤灰是燃煤产生的工业固体废料,主要成分有Al2O3、SiO2 ,还含有少量Fe2O3、CaO等。采用酸碱联合的方法从粉煤灰中综合回收氧化铝及二氧化硅的工艺流程如下:
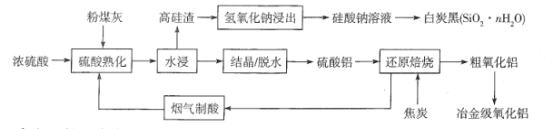
硫酸熟化过程中发生的反应有:
Al2O32SiO2 +3H2SO4=Al(SO4)3 +2SiO2 +3H2O
3Al2O32SiO2 +9H2SO4=3Al2( SO4)3 + 2SiO2 +9H2O
(1)“结晶”操作:缓缓加热,浓缩至______ ,放置冷却,得到Al2(SO4)318H2O。
(2)Al2(SO4)318H2O在250 ~300℃下失重40.5%得Al2(SO4)xH2O,x=______。
(3)“还原焙烧”过程中发生反应的化学方程式为_________。
(4)设计实验检验粗氧化铝中是否含有Fe2O3: __________。
(5)向硅酸钠溶液中通入过量CO2制备白炭黑的化学方程式为___________。
(6)粗氧化铝制备冶金级氧化铝过程中发生反应[ Al(OH)4]- +CO2 =Al(OH)3↓+ HCO3- ,该反应的平衡常数为_______[已知 Al(OH)3+H2O![]() [ Al(OH)4]-+H+ K1 =4×10-13 ;H2CO3
[ Al(OH)4]-+H+ K1 =4×10-13 ;H2CO3![]() H2O +CO2 K2 =600; Kal(H2CO3) =4.2×10-7、Ka2(H2CO3) =5.6×10-11]。
H2O +CO2 K2 =600; Kal(H2CO3) =4.2×10-7、Ka2(H2CO3) =5.6×10-11]。
【答案】表面出现结晶薄膜 3 2Al2(SO4)3+3C![]() 2Al2O3+3CO2↑+6SO2↑ 取粗氧化铝少许于试管中加稀硫酸溶解,静置,滴加KSCN溶液,若溶液变红,则粗氧化铝中含有Fe2O3杂质 Na2SiO3+2CO2+(n+1)H2O=2NaHCO3+SiO2nH2O↓ 1.75×103
2Al2O3+3CO2↑+6SO2↑ 取粗氧化铝少许于试管中加稀硫酸溶解,静置,滴加KSCN溶液,若溶液变红,则粗氧化铝中含有Fe2O3杂质 Na2SiO3+2CO2+(n+1)H2O=2NaHCO3+SiO2nH2O↓ 1.75×103
【解析】
粉煤灰主要成分有Al2O3、SiO2 ,还含有少量Fe2O3、CaO等,加入浓硫酸反应生成硫酸铝,水浸主要得到SiO2高硅渣,滤液经过结晶脱水得到硫酸铝,硫酸铝与焦炭反应生成粗氧化铝,验证粗氧化铝是否含有氧化铁,先将物质溶于稀硫酸后加KSCN溶液,观察现象;向硅酸钠溶液中通入足量二氧化碳反应生成碳酸氢钠和白炭黑SiO2nH2O。
(1)“结晶”操作:缓缓加热,浓缩至表面出现结晶薄膜,放置冷却,得到Al2(SO4)318H2O;故答案为:表面出现结晶薄膜。
(2)假设100gAl2(SO4)318H2O在250 ~300℃下失重40.5%,剩余100g×(140.5%)=59.5g Al2(SO4)xH2O,![]() ,解得x=3;故答案为:3。
,解得x=3;故答案为:3。
(3)根据“还原焙烧”产物之一经过烟气制酸,硫酸铝和碳“还原焙烧”生成氧化铝、二氧化碳和二氧化硫,发生反应的化学方程式为2Al2(SO4)3+3C![]() 2Al2O3+3CO2↑+6SO2↑;故答案为:2Al2(SO4)3+3C
2Al2O3+3CO2↑+6SO2↑;故答案为:2Al2(SO4)3+3C![]() 2Al2O3+ 3CO2↑ + 6SO2↑。
2Al2O3+ 3CO2↑ + 6SO2↑。
(4)实验检验粗氧化铝中是否含有Fe2O3,将粗品溶于稀硫酸中,利用生成的铁离子与KSCN溶液反应是否有红色物质生成;故答案为:取粗氧化铝少许于试管中加稀硫酸溶解,静置,滴加KSCN溶液,若溶液变红,则粗氧化铝中含有Fe2O3杂质。
(5)向硅酸钠溶液中通入过量CO2生成碳酸氢钠和白炭黑SiO2nH2O,其化学方程式为Na2SiO3+2CO2+(n+1)H2O=2NaHCO3+SiO2nH2O↓;故答案为:Na2SiO3+2CO2+(n+1)H2O = 2NaHCO3+SiO2nH2O↓。
(6)①Al(OH)3+H2O![]() [ Al(OH)4]-+H+,②H2CO3
[ Al(OH)4]-+H+,②H2CO3![]() H2O +CO2,③H2CO3
H2O +CO2,③H2CO3![]() HCO3-+H+,根据盖斯定律③①②得到[Al(OH)4] - +CO2 =Al(OH)3↓+ HCO3-,方程式相减,平衡常数相除,因此[Al(OH)4] - +CO2 =Al(OH)3↓+ HCO3-平衡常数为
HCO3-+H+,根据盖斯定律③①②得到[Al(OH)4] - +CO2 =Al(OH)3↓+ HCO3-,方程式相减,平衡常数相除,因此[Al(OH)4] - +CO2 =Al(OH)3↓+ HCO3-平衡常数为![]() ;故答案为:1.75×103。
;故答案为:1.75×103。

【题目】某研究性学习小组利用软锰矿浆(主要成分是MnO2)吸收工业废气中的SO2,并制备硫酸锰的生产流程如下(浸出液的pH<2,其中除含Mn2+外,还含有少量Fe2+、Al3+、Ca2+等金属离子):

“操作1”的滤液通过阳离子吸附剂除去Ca2+。金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
Mn2+ | 8.3 | 9.8 |
(1)浸出过程中被氧化的物质的化学式为____________。
(2)氧化过程中主要反应的离子方程式为_____________
(3)在氧化后的液体中加入石灰浆调节pH, pH 的范围是__________。
(4)操作2包括蒸发浓缩、__________、 过滤、 洗涤、干燥等操作。
(5)为测定所得MnSO4·H2O的纯度,准确称取上述样品1.720 g加入适量H2SO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+后,配成200 mL溶液。取20.00 mL该溶液,向其中逐滴加入0.0500 mol·L-1的FeSO4溶液,发生如下反应: Fe2+ +Mn3+=== Fe3+ + Mn2+当反应恰好完全进行时,共消耗FeSO4溶液19.50 mL。计算MnSO4·H2O的纯度(写出计算过程,结果保留四位有效数字)__