题目内容
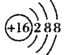
【题目】有一种化合物结构如图所示,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,X、Y是同周期元素,Z的含氧酸均具有氧化性,该化合物相对分子质量小于125。下列有关说法正确的是
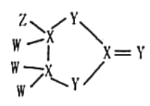
A.WZ沸点高于W2Y的沸点
B.X的含氧酸一定为二元弱酸
C.原子半径大小:Z>Y>X>W
D.X与Z组成的化合物中可能含有非极性键
【答案】D
【解析】
根据该物质中各元素的成键特点可知W、Z为H、F或Cl中两种,因W在四种元素中原子序数最小,则W不可能是Cl,为H或F;X、Y同周期,X应为第ⅣA族元素,Y应为第ⅥA族元素,若X、Y分别为Si和S,则Z为Cl,此时该物质的相对分子量至少为28×3+32×3+35.5>125,故不符合题意,所以X为C,Y为O,则W只能为H,又因为Z的含氧酸均具有酸性,所以Z为Cl。
A.H2O分子间存在氢键,导致其沸点较高,即沸点:HCl<H2O,故A错误;
B.C可以形成无机酸碳酸,也可以形成有机一元酸,如甲酸、乙酸等,所以X的含氧酸不一定为二元弱酸,故B错误;
C.同一周期从左向右原子半径逐渐减小,同一主族从上到下原子半径逐渐增大,则原子半径大小:Z>X>Y>W,故C错误;
D.C与Cl形成的化合物中含有多个C原子时,其中含有的C-C键为非极性键,故D正确;
故选:D。

 考前必练系列答案
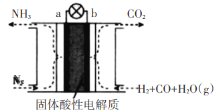
考前必练系列答案【题目】某研究性学习小组利用软锰矿浆(主要成分是MnO2)吸收工业废气中的SO2,并制备硫酸锰的生产流程如下(浸出液的pH<2,其中除含Mn2+外,还含有少量Fe2+、Al3+、Ca2+等金属离子):

“操作1”的滤液通过阳离子吸附剂除去Ca2+。金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
Mn2+ | 8.3 | 9.8 |
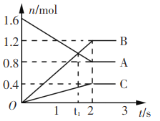
(1)浸出过程中被氧化的物质的化学式为____________。
(2)氧化过程中主要反应的离子方程式为_____________
(3)在氧化后的液体中加入石灰浆调节pH, pH 的范围是__________。
(4)操作2包括蒸发浓缩、__________、 过滤、 洗涤、干燥等操作。
(5)为测定所得MnSO4·H2O的纯度,准确称取上述样品1.720 g加入适量H2SO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+后,配成200 mL溶液。取20.00 mL该溶液,向其中逐滴加入0.0500 mol·L-1的FeSO4溶液,发生如下反应: Fe2+ +Mn3+=== Fe3+ + Mn2+当反应恰好完全进行时,共消耗FeSO4溶液19.50 mL。计算MnSO4·H2O的纯度(写出计算过程,结果保留四位有效数字)__