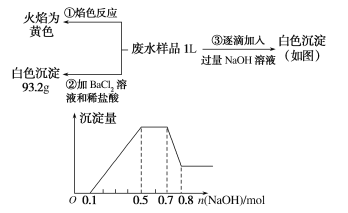
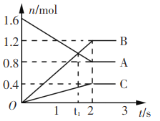
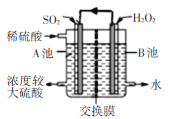
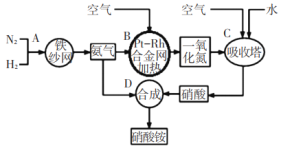
题目内容
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.工业制硫酸的反应中,若通入128 g SO2,生成SO3的分子数目为2NA
B.2 mol Na2S分子中含有S原子的数目为2NA
C.标准状况下,6.72 L NH3溶于水后,溶液中NH3·H2O和![]() 数目之和为0.3NA
数目之和为0.3NA
D.Zn与浓硫酸充分反应后,收集到气体0.5 mol,电子转移的数目为NA
【答案】D
【解析】
根据反应可逆原理判断物质的量,锌与硫酸反应先生成二氧化硫,后生成氢气,根据电荷转移守恒进行计算。
A. 工业制硫酸的反应中,通入128 g 即2molSO2,2SO2+2O22SO3反应可逆,生成SO3的物质的量小于2mol,分子数目小于2NA,A错误;
B. Na2S是离子化合物,不存在Na2S分子,B错误;
C. 标准状况下,6.72 L 即0.3molNH3溶于水后,溶液中存在NH3、NH3·H2O、NH4+三种粒子,溶液中NH3·H2O和![]() 数目之和小于0.3NA,C错误;
数目之和小于0.3NA,C错误;
D. Zn与浓硫酸反应生成二氧化硫,根据电子转移守恒,Zn~SO2,若反应一段时候后硫酸浓度下降,开始生成氢气,根据电子转移守恒,Zn~H2,即无论反应到哪步,生成0.5mol气体,都消耗0.5mol锌,反应转移1NA电子,D正确。
答案为D。

练习册系列答案
相关题目