题目内容
20.空气吹出法工艺是目前“海水提溴”的最主要方法之一.其工艺流程如下: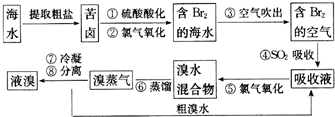
(1)溴在周期表中位于第4周期,第VIIA族.
(2)步骤②中反应的离子方程式是2Br-+Cl2=Br2+2Cl-.
(3)步骤④利用了SO2的还原性,反应的离子方程式为Br2+SO2+2H2O=4H++2Br-+SO42-.
(4)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离.分离仪器的名称是分液漏斗.
分析 (1)根据溴在氯的下一周期,与氯在同一主族来解答;
(2)步骤②中氯气将溴离子氧化成溴单质,据此写出反应的离子方程式;
(3)步骤④中溴单质与二氧化硫发生氧化还原反应生成硫酸和溴化氢;
(4)根据分液是分离两种不相溶的液体,用分液漏斗分离.
解答 解:(1)因溴在氯的下一周期,与氯在同一主族,所以溴在周期表中位于第4周期VIIA族,
故答案为:4;VIIA;
(2)步骤②为氯气与溴离子反应生成溴单质,反应的离子方程式为:2Br-+Cl2=Br2+2Cl-,
故答案为:2Br-+Cl2=Br2+2Cl-;
(3)SO2和溴单质、水反应生成硫酸和氢溴酸,反应的离子方程式为:Br2+SO2+2H2O=4H++2Br-+SO42-,
故答案为:Br2+SO2+2H2O=4H++2Br-+SO42-;
(4)因液溴与溴水不相溶,可用分液漏斗通过分液操作分离,
故答案为:分液漏斗.
点评 本题考查了海水资源的综合利用,题目难度中等,注意掌握常见物质性质、离子方程式书写原则及化学实验基本操作方法,试题培养了学生运用知识分析问题和解决问题的能力.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
11.下列不能用来鉴别乙烷和乙烯的方法是( )
| 选项 | 试剂或操作 | 鉴别方法 |
| A | 点燃 | 观察火焰 |
| B | 酸性高锰酸钾溶液 | 观察溶液颜色变化 |
| C | 水 | 观察水溶液 |
| D | 溴的四氯化碳溶液 | 观察溶液颜色变化 |
| A. | A | B. | B | C. | C | D. | D |
8.常温下,下列溶液中说法正确的是( )
| A. | 0.2mol•L-1氨水中滴入0.2mol•L-1CH3COOH溶液可能存在:c(NH4+)-(CH3COO-)>c(OH-)-c(H+) | |
| B. | pH=5.6的NaHSO3溶液:c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) | |
| C. | 向BaSO4悬浊液中加入Na2SO4固体,Ksp(BaSO4)变小 | |
| D. | 若pOH=-lgc(OH-),则pH=3的盐酸与pOH=3的氨水等体积混合溶液,PH>7 |
5.下列指定反应的离子方程式正确的是( )
| A. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ | |
| B. | NH4Al(SO4)2溶液与过量稀氨水反应:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| C. | 用稀硝酸清洗试管内壁的银镜:Ag+2H++NO3-=Ag++NO2↑+H2O | |
| D. | FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
4.下列说法正确的是( )

| A. | 常温下,22.4L H2O所含的分子数大于NA | |
| B. | 已知CH3COONH4溶液的PH=7,则1L 0.1mol/L的CH3COONH4溶液中,CH3COO- 数为0.1NA | |
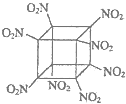
| C. | 科学家研制出的八硝基立方烷(结构如右图所示,碳原子未画出)1 mol该分子中含8 mol二氧化氮 | |
| D. | 标准状况下,33.6L二氯甲烷中含有氯原子的数目为3NA |
5.25℃时,下列溶液中有关微粒的物质的量浓度关系错误的是( )
| A. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) | |
| B. | pH=10的Na2A溶液中:2 c(Na+)=c(HA-)+c(H2A)+c(A2-) | |
| C. | 等物质的量浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) | |
| D. | 氨水和氯化铵的混合溶液,可能会出现c(NH${\;}_{4}^{+}$)>c(Cl-)>c(H+)>c(OH-) |

 ;其所含化学键类型为共价键、离子键;
;其所含化学键类型为共价键、离子键;