题目内容
12.某有机化合物6.4g在氧气中完全燃烧,生成8.8g CO2和7.2g H2O,求该有机化合物的分子式.分析 有机物燃烧生成8.8gCO2和7.2gH2O,则一定含有C、H元素,其中n(CO2)=$\frac{8.8g}{44g/mol}$=0.2mol,n(H2O)=$\frac{7.2g}{18g/mol}$=0.4mol,以此计算C、H元素的质量,根据质量守恒,判断是否含有O元素,然后确定有机化合物的分子式.
解答 解:有机物燃烧生成8.8gCO2和7.2gH2O,则一定含有C、H元素,其中n(CO2)=$\frac{8.8g}{44g/mol}$=0.2mol,n(H2O)=$\frac{7.2g}{18g/mol}$=0.4mol,
n(C)=n(CO2)=0.2mol,m(C)=0.2mol×12g/mol=2.4g,n(H)=2n(H2O)=0.8mol,m(H)=0.8g,m(O)=2.4g+0.8g=3.2g<6.4g,则该有机物含有氧元素,含有O元素的物质的量为:$\frac{6.4g-3.2g}{16g/mol}$=0.2mol,则n(C):n(H):n(O)=0.2mol:(0.4mol×2):0.2mol=1:4:1,
该化合物中的最简式为:CH4O,由于H原子已经达到饱和,则其最简式即为其分子式,即分子式为CH4O,
答:有机化合物的分子式为CH4O.
点评 本题考查了有机物分子式的确定,题目难度中等,注意掌握质量守恒在确定有机物分子式中的应用,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
2.(NH4)2PtCl6晶体受热分解,生成氮气、氯化氢、氯化铵和金属铂.在此分解反应中,还原产物与氧化产物的物质的量之比是( )
| A. | 2:3 | B. | 1:3 | C. | 4:3 | D. | 3:2 |
7.下列关于各图的叙述正确的是( )
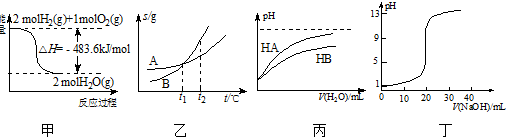

| A. | 甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•mol-1 | |
| B. | 乙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数ω(B)>ω( A) | |
| C. | 丙表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度NaB溶液的pH | |
| D. | 丁表示0.1000 mol•L-1 NaOH溶液滴定20.00 mL 0.1000 mol•L-1醋酸溶液得到的滴定曲线 |
4.下列说法不正确的是( )
| A. | 用溴水可以鉴别苯、苯酚、己烷、己烯 | |
| B. | 麦芽糖在水解前后均能发生银镜反应 | |
| C. | 1-氯丙烷和2-氯丙烷发生消去反应的产物相同 | |
| D. | 分子式为C2H4和C4H8的物质一定互为同系物 |
16.下列物质的电子式书写正确的是( )
| A. | Na2O | B. | H2S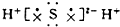 | C. | H2O2 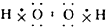 | D. | N2 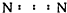 |
17.已知苯跟一卤代烷在催化剂作用下,可生成苯的同系物.如在催化剂作用下:
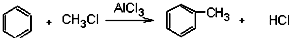 ,苯和下列各组物质合成乙苯最好应选用的是( )
,苯和下列各组物质合成乙苯最好应选用的是( )
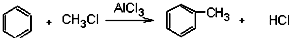 ,苯和下列各组物质合成乙苯最好应选用的是( )
,苯和下列各组物质合成乙苯最好应选用的是( )| A. | CH3CH3和Cl2 | B. | CH2=CH2和HCl | C. | CH2=CH2和Cl2 | D. | CH3CH3和HCl |
 (其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.
(其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.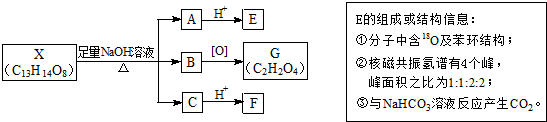
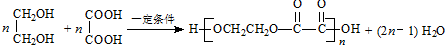 .
. .
.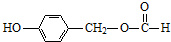 (写结构简式).
(写结构简式).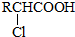
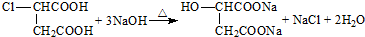 .
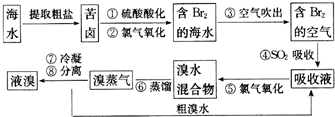
.
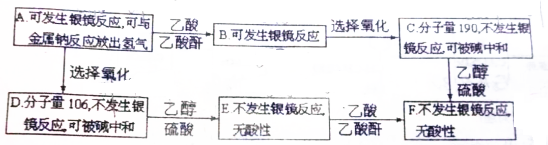
 .
.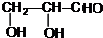 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$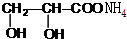 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.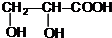 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$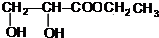 +H2O,属于取代反应(填反应类型).
+H2O,属于取代反应(填反应类型).