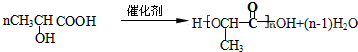
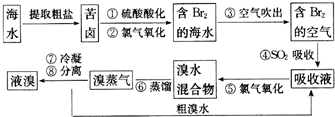
题目内容
15.如图1是部分短周期元素的常见化合价与原子序数的关系图:
(1)写出A在元素周期表中的位置第二周期ⅣA族;
(2)D在空气中燃烧生成物的电子式为
 ;其所含化学键类型为共价键、离子键;
;其所含化学键类型为共价键、离子键;(3)C2-、D+、G2-离子半径大小顺序是S2->O2->Na+(用离子符号回答);
(4)C、G元素所形成的氢化物稳定性为H2S<H2O(填化学式),原因是:O的非金属性大于S;
(5)A的某氢化物分子式为A2H6,将含630mol电子的A2H6在氧气中完全燃烧生成稳定氧化物放出的热量为QkJ,请写出表示A2H6燃烧热的热化学方程式:C2H6(g)+$\frac{7}{2}$O2(g)=2CO2(g)+3H2O(L)?△H=-$\frac{Q}{35}$kJ•mol-1;
(6)某同学设计实验证明A、B、F的非金属性强弱关系,装置如图2.
①溶液a和b分别为硝酸,饱和NaHCO3溶液;
②溶液c中发生反应的离子方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-或SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-.
分析 由图中化合价可知,A、F的化合价都为+4、-4价,二者同主族,且F的原子序数较大,故A为C元素、故F为Si元素;C的化合价为-2价,没有正化合价,故C为O元素;D的化合价为+1价,处于ⅠA族,原子序数大于O元素,故D为Na元素;E为+3价,为Al元素;G的最高正价为+6价、最低价为-2,应为S元素;B的有+5、-3价,处于ⅤA族,原子序数介于C、O之间,则B为N元素,
(1)A为C元素,位于周期表第二周期ⅣA族;
(2)D为Na元素,空气中燃烧生成物为过氧化钠,为离子化合物,含有共价键、离子键;
(3)电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大;
(4)非金属性O>S,元素的非金属性越强,对应的氢化物越稳定;
(5)A为C元素,氢化物分子式为C2H6,1molC2H6含有18mol电子,含630mol电子的C2H6的物质的量为$\frac{630}{18}$mol=35mol;
(6)由装置图可知,实验原理是利用强酸制备弱酸,硝酸易挥发,为防止干扰应除去,故锥形瓶中产生二氧化碳,应为硝酸与碳酸盐反应,溶液b吸收挥发的硝酸,应为饱和的碳酸氢钠,烧杯中应是二氧化碳与硅酸钠反应生成硅酸.
解答 解:由图中化合价可知,A、F的化合价都为+4、-4价,二者同主族,且F的原子序数较大,故A为C元素、故F为Si元素;C的化合价为-2价,没有正化合价,故C为O元素;D的化合价为+1价,处于ⅠA族,原子序数大于O元素,故D为Na元素;E为+3价,为Al元素;G的最高正价为+6价、最低价为-2,应为S元素;B的有+5、-3价,处于ⅤA族,原子序数介于C、O之间,则B为N元素,
(1)A为C元素,原子核外有2个电子层,最外层电子数为4,则位于周期表第二周期ⅣA族,故答案为:第二周期ⅣA族;
(2)D为Na元素,空气中燃烧生成物为过氧化钠,为离子化合物,含有共价键、离子键,电子式为 ,
,
故答案为: ; 共价键、离子键;
; 共价键、离子键;
(3)电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->O2->Na+,故答案为:S2->O2->Na+;
(4)非金属性O>S,元素的非金属性越强,对应的氢化物越稳定,则非金属性H2S<H2O,故答案为:H2S<H2O;O的非金属性大于S;
(5)A为C元素,氢化物分子式为C2H6,1molC2H6含有18mol电子,含630mol电子的C2H6的物质的量为$\frac{630}{18}$mol=35mol,
在氧气中完全燃烧生成稳定氧化物放出的热量为QkJ,则C2H6燃烧热的热化学方程式为C2H6(g)+$\frac{7}{2}$O2(g)=2CO2(g)+3H2O(L)?△H=-$\frac{Q}{35}$ kJ•mol-1,
故答案为:C2H6(g)+$\frac{7}{2}$O2(g)=2CO2(g)+3H2O(L)?△H=-$\frac{Q}{35}$ kJ•mol-1;
(6)由装置图可知,实验原理是利用强酸制备弱酸,硝酸易挥发,为防止干扰应除去,故锥形瓶中产生二氧化碳,应为硝酸与碳酸盐反应,溶液b吸收挥发的硝酸,应为饱和的碳酸氢钠,烧杯中应是二氧化碳与硅酸钠反应生成硅酸,
①由上述分析可知,溶液a为硝酸,溶液b为饱和NaHCO3溶液,故答案为:硝酸;饱和NaHCO3溶液;
②溶液c中的离子方程式为:SiO32-+CO2+H2O=H2SiO3↓+CO32-或SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,
故答案为:SiO32-+CO2+H2O=H2SiO3↓+CO32-或SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-.
点评 本题考查结构性质位置关系,为高考常见题型和高频考点,侧重于学生的分析、计算和实验能力的考查,题目涉及半径比较、电子式、化学实验、氧化还原反应计算、离子方程式的书写等,难度中等,注意把握非金属性的比较角度.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 常温常压下,1mol21H2含有nA个质子 | |
| B. | 1molCu与足量FeCl3溶液充分反应转移了2nA个电子 | |
| C. | 含49gH2SO4的硫酸溶液中含有nA个氢原子 | |
| D. | 标准状况下,22.4L甲醇含有nA个分子 |
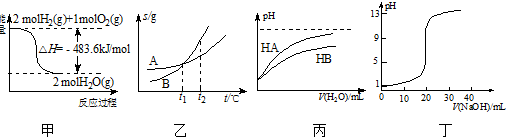
| A. | 甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•mol-1 | |
| B. | 乙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数ω(B)>ω( A) | |
| C. | 丙表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度NaB溶液的pH | |
| D. | 丁表示0.1000 mol•L-1 NaOH溶液滴定20.00 mL 0.1000 mol•L-1醋酸溶液得到的滴定曲线 |
| A. | 用溴水可以鉴别苯、苯酚、己烷、己烯 | |
| B. | 麦芽糖在水解前后均能发生银镜反应 | |
| C. | 1-氯丙烷和2-氯丙烷发生消去反应的产物相同 | |
| D. | 分子式为C2H4和C4H8的物质一定互为同系物 |
| A. | 标准状况下,22.4L苯含有NA个苯分子 | |
| B. | 0.2 mol•L-1 FeCl3溶液中含有Cl-总数为0.6NA | |
| C. | 在标准状况下,含4molHCl的浓盐酸与足量的MnO2反应可生成22.4L氯气 | |
| D. | 4g氦气所含分子数为NA |
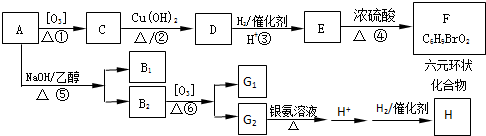
 (其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.
(其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.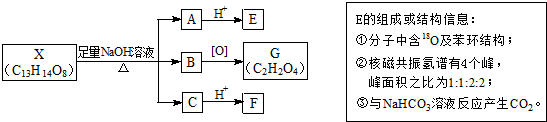
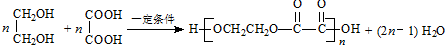 .
. .
.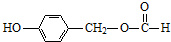 (写结构简式).
(写结构简式).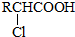
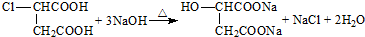 .
.
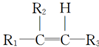 $\stackrel{[O_{3}]}{→}$
$\stackrel{[O_{3}]}{→}$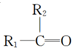 +
+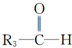
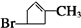

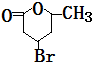 +H2O
+H2O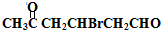 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$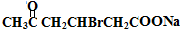 +Cu2O↓+3H2O
+Cu2O↓+3H2O