题目内容
5.25℃时,下列溶液中有关微粒的物质的量浓度关系错误的是( )| A. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) | |
| B. | pH=10的Na2A溶液中:2 c(Na+)=c(HA-)+c(H2A)+c(A2-) | |
| C. | 等物质的量浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) | |
| D. | 氨水和氯化铵的混合溶液,可能会出现c(NH${\;}_{4}^{+}$)>c(Cl-)>c(H+)>c(OH-) |
分析 A.根据混合液中的电荷守恒判断;
B.根据溶液中的物料守恒分析;
C.根据混合液中的物料守恒判断;
D.氨水和氯化铵的混合溶液,氨水较多,一水合氨电离大于铵根离子水解.
解答 解:A.溶液中遵循电荷守恒,则pH=2的HA溶液与pH=12的MOH溶液以任意比混合都有:c(H+)+c(M+)=c(OH-)+c(A-),故A正确;
B.pH=10的Na2A溶液中,根据物料守恒可得:2c(Na+)=2c(HA-)+2c(H2A)+2c(A2-),故B错误;
C.等物质的量浓度的NaClO、NaHCO3混合溶液中,根据物料守恒可得:c(HClO)+c(ClO-)=c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),故C正确;
D.氨水和氯化铵的混合溶液,氨水较多,一水合氨电离大于铵根离子水解,则会出现c(NH4+)>c(Cl-)>c(H+)>c(OH-),故D正确;
故选B.
点评 本题考查离子浓度大小的比较,题目难度中等,明确盐的水解原理及电荷守恒、物料守恒是解答本题的关键,注意掌握判断离子浓度大小常用方法.

练习册系列答案
相关题目
16.下列物质的电子式书写正确的是( )
| A. | Na2O | B. | H2S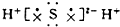 | C. | H2O2 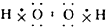 | D. | N2 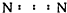 |
13.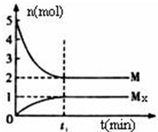 E是非金属性最强的主族元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下转化关系:aM(g)?bMx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
E是非金属性最强的主族元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下转化关系:aM(g)?bMx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
 E是非金属性最强的主族元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下转化关系:aM(g)?bMx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
E是非金属性最强的主族元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下转化关系:aM(g)?bMx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )| A. | 平衡时混合气体的平均摩尔质量是33.3g/mol | |
| B. | t1时刻,保持温度不变,再充入5molM,重新达到平衡时,c(Mx)/c(M)将减小 | |
| C. | 该反应的化学方程式是2HF?(HF)2 | |
| D. | M的沸点比同主族下一周期元素的气态氢化物沸点低 |
20.以NA表示阿佛加德罗常数,下列说法中正确的是( )
| A. | 标准状况下,22.4L苯含有NA个苯分子 | |
| B. | 0.2 mol•L-1 FeCl3溶液中含有Cl-总数为0.6NA | |
| C. | 在标准状况下,含4molHCl的浓盐酸与足量的MnO2反应可生成22.4L氯气 | |
| D. | 4g氦气所含分子数为NA |
17.已知苯跟一卤代烷在催化剂作用下,可生成苯的同系物.如在催化剂作用下:
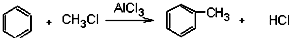 ,苯和下列各组物质合成乙苯最好应选用的是( )
,苯和下列各组物质合成乙苯最好应选用的是( )
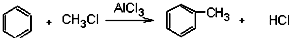 ,苯和下列各组物质合成乙苯最好应选用的是( )
,苯和下列各组物质合成乙苯最好应选用的是( )| A. | CH3CH3和Cl2 | B. | CH2=CH2和HCl | C. | CH2=CH2和Cl2 | D. | CH3CH3和HCl |
14.某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图.下列有关说法正确的是( )
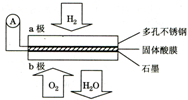

| A. | a极为负极,工作过程中a极附近酸性增强 | |
| B. | 电池总反应可表示为:2H2+O2=2H2O | |
| C. | H+由b极通过固体酸电解质传递到a极 | |
| D. | 每转移0.1mol电子,消耗标准状况下2.24L H2 |
15.NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 常温常压下,22.4L CO2中含有NA个CO2分子 | |
| B. | 常温下,1L 0.1mol/LNa2S溶液中,含有S2-数为0.1NA | |
| C. | 7.8 g过氧化钠与足量二氧化碳反应转移的电子数为0.1NA | |
| D. | 在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,每生成3 mol Cl2转移的电子数为6NA |