题目内容
8.常温下,下列溶液中说法正确的是( )| A. | 0.2mol•L-1氨水中滴入0.2mol•L-1CH3COOH溶液可能存在:c(NH4+)-(CH3COO-)>c(OH-)-c(H+) | |
| B. | pH=5.6的NaHSO3溶液:c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) | |
| C. | 向BaSO4悬浊液中加入Na2SO4固体,Ksp(BaSO4)变小 | |
| D. | 若pOH=-lgc(OH-),则pH=3的盐酸与pOH=3的氨水等体积混合溶液,PH>7 |
分析 A.反应后溶质为醋酸铵,根据醋酸铵溶液中的电荷守恒判断;
B.pH=5.6的NaHSO3溶液,亚硫酸氢根离子的电离程度大于其水解程度,c(SO32-)>c(H2SO3);
C.溶度积只与温度有关,温度不变,则溶度积不变;
D.pOH=3的氨水中氢氧根离子浓度为0.001mol/L,一水合氨为弱碱,则混合液中氨水过量,溶液显示碱性.
解答 解:A.0.2mol•L-1氨水中滴入0.2mol•L-1CH3COOH溶液,二者恰好反应生成醋酸铵,根据电荷守恒可得:c(NH4+)+c(H+)=c(OH-)+c(CH3COO-),则:c(NH4+)-(CH3COO-)=c(OH-)-c(H+),故A错误;
B.NaHSO3溶液的pH=5.6,说明HSO3-的电离程度大于其水解程度,则:c(SO32-)>c(H2SO3),溶液中正确的离子浓度大小为:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),故B错误;
C.向BaSO4悬浊液中加入Na2SO4固体,由于温度不变,则Ksp(BaSO4)不变,故C错误;
D.pOH=-lgc(OH-),则pH=3的盐酸中氢离子浓度为0.001mol/L,pOH=3的氨水中氢氧根离子浓度为0.001mol/L,由于一水合氨为弱碱,两溶液等体积混合后氨水过量,混合液显示碱性,则混合液的pH>7,故D正确;
故选D.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断等知识,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列说法正确的是( )
| A. | 溶液、胶体、浊液三种分散系可用丁达尔效应进行区分 | |
| B. | △H<0且△S>0的反应可以自发进行 | |
| C. | 酸碱中和滴定实验中装标准液的滴定管未润洗,会造成所测结果偏低 | |
| D. | 钢铁吸氧腐蚀的负极反应为:O2+4e-+2H2O═4OH- |
16.设NA为阿伏加德罗常数,下列叙述正确的是(相对原子质量O-16 Na-23)( )
| A. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 100 mL 1 mol•L-1的H2SO4溶液中含有0.1NA个H+ | |
| C. | 将4 g NaOH溶于100 g蒸馏水中,所得溶液物质的量浓度是0.1 mol•L-1 | |
| D. | 20g重水(D2O)所含的电子数为10NA |
13.下列说法正确的是( )
| A. | 向水中加入少量固体硫酸氢钠,恢复原温度时,c(H+)增大,Kw变大 | |
| B. | 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者用时少 | |
| C. | 0.1 mol.L-1的醋酸溶液加水稀释,$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 | |
| D. | 常温下,V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
13.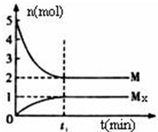 E是非金属性最强的主族元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下转化关系:aM(g)?bMx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
E是非金属性最强的主族元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下转化关系:aM(g)?bMx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
 E是非金属性最强的主族元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下转化关系:aM(g)?bMx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
E是非金属性最强的主族元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下转化关系:aM(g)?bMx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )| A. | 平衡时混合气体的平均摩尔质量是33.3g/mol | |
| B. | t1时刻,保持温度不变,再充入5molM,重新达到平衡时,c(Mx)/c(M)将减小 | |
| C. | 该反应的化学方程式是2HF?(HF)2 | |
| D. | M的沸点比同主族下一周期元素的气态氢化物沸点低 |
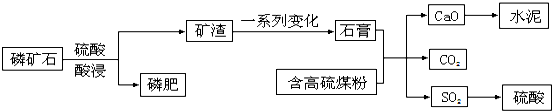
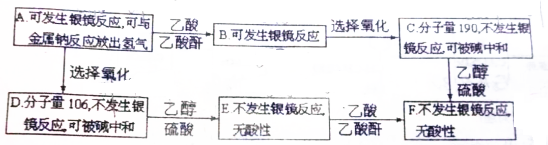
 (其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.
(其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.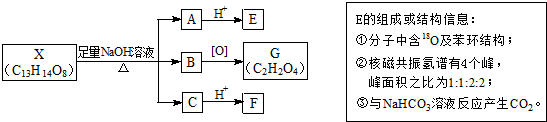
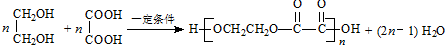 .
. .
.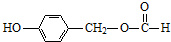 (写结构简式).
(写结构简式).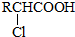
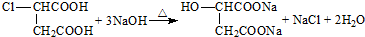 .
.
 .
.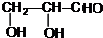 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$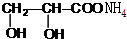 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.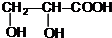 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$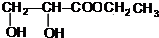 +H2O,属于取代反应(填反应类型).
+H2O,属于取代反应(填反应类型).