题目内容
14.在A装置中用4.35gMnO2与50mL12mol/L的足量浓盐酸反应制Cl2,当MnO2完全反应后,再向反应后的溶液中加入过量的AgNO3溶液,假设整个过程中产生的Cl2全部排出并且无氯化氢气体挥发出来,请计算生成AgCl沉淀的质量.(写出计算过程)分析 n(MnO2)=$\frac{4.35g}{87g/mol}$=0.05mol,n(HCl)=12mol/L×0.05L=0.6mol,根据转移电子守恒得n(Cl2),根据Cl原子守恒计算剩余n(HCl),根据Cl原子守恒计算n(AgCl),再结合m=nM计算AgCl质量.
解答 解:n(MnO2)=$\frac{4.35g}{87g/mol}$=0.05mol,n(HCl)=12mol/L×0.05L=0.6mol,根据转移电子守恒得n(Cl2)=$\frac{0.05mol×2}{2}$=0.05mol,根据Cl原子守恒计算剩余n(HCl)=n(HCl)(原来)-2n(Cl2)=0.6mol-2×0.05mol=0.5mol,根据Cl原子守恒得n(AgCl)=n(HCl)(剩余)=0.5mol,m(AgCl)=n(AgCl).M(AgCl)=0.5mol×143.5g/mol=71.75g,答:生成氯化银的质量是71.75g.
点评 本题考查化学方程式有关计算,侧重考查学生发生计算能力,正确判断各个物理量关系是解本题关键,注意原子守恒、转移电子守恒的灵活运用,题目难度不大.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
9.下列说法正确的是( )
| A. | 用pH试纸测氯水的pH | |
| B. | 保存液溴时液面覆盖一层水,并装在带玻璃塞的试剂瓶中 | |
| C. | 用稀盐酸清洗做过银镜反应的试管内壁 | |
| D. | 除去NaBr溶液中的NaI,可先加氯水,再用CCl4萃取分液 |
19.下列说法不正确的是( )
| A. | Al箔插入稀HNO3中无现象因Al箔表面被HNO3氧化,形成致密的氧化膜 | |
| B. | 如图所示,①为AlCl3溶液,②中为浓氨水,①中有白色沉淀生成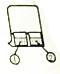 | |
| C. | Al2O3$\stackrel{NaOH(aq)}{→}$NaAlO2(aq)→Al(OH)3 | |
| D. | AlCl3溶液中滴加NaOH后铝元素的存在形式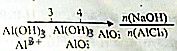 |
1.一定温度下,在2L的密闭容器中加入4mol A和6mol B,发生如下反应:2A(g)+3B(g)?4C(g)+D(g),反应10min后达到平衡,此时D的浓度是0.5mol•L-1.下列说法正确的是( )
| A. | 10 min后向容器中加入A,再次达平衡时,A的转化率一定大于50% | |
| B. | 前10 min内反应的平均速率υ(C)=0.1 mol•L-1•min-1 | |
| C. | 恒温下,将压强变为原来的2倍,则再次达平衡时D的浓度小于1 mol•L-1 | |
| D. | 反应达平衡时c(B)=1.5 mol•L-1 |
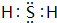 ,1molC的氢化物与足量的C的氧化物反应,转移的电子的物质的量为2mol
,1molC的氢化物与足量的C的氧化物反应,转移的电子的物质的量为2mol 以天然气为原料合成甲醇常见的方法有水煤气法和目前正在开发的直接氧化法
以天然气为原料合成甲醇常见的方法有水煤气法和目前正在开发的直接氧化法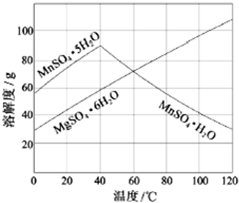 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2═MnSO4.
软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2═MnSO4.