题目内容
7.将0.2moL AgNO3、0.4moLCu(NO3)2、0.6moLKCl溶于水,配成100mL的溶液,用石墨做电极电解一段时间后,在一极析出0.3moLCu,此时在另一极收集到气体体积为(标况)( )| A. | 4.48L | B. | 5.6L | C. | 6.72L | D. | 7.84L |
分析 依据电解原理和电解质溶液中离子放电顺序分析得到先后发生的反应:Cu2++2Cl-$\frac{\underline{\;通电\;}}{\;}$Cu+Cl2↑①,2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+②,在阴极析出0.3moLCu,可以计算转移电子的量,依据电子守恒列式计算另一极得到的气体的物质的量.
解答 解:三种物质溶于水时,AgNO3与KCl反应后溶液中含有0.2 mol KNO3、0.4 mol Cu(NO3)2和0.4 mol KCl.当有0.3 mol Cu生成时,先后发生反应:Cu2++2Cl-$\frac{\underline{\;通电\;}}{\;}$Cu+Cl2↑①,2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+②,在阳极上先后生成Cl2和O2.n(Cl2)=$\frac{1}{2}$n(KCl)=$\frac{1}{2}$×0.4 mol=0.2 mol,根据电子守恒有:0.3 mol×2=0.2 mol×2+4n(O2),解得n(O2)=0.05 mol,所以阳极共产生气体体积为(0.2 mol+0.05 mol )×22.4 L•mol-1=5.6L.
故选B.
点评 本题考查了电解池原理的分析应用,主要是电极反应和电子守恒的计算,依据电解原理和电解质溶液中离子放电顺序分析电极反应,结合题干离子物质的量和电子转移来确定发生电解反应的物质和生成产物,依据电子守恒列式计算得到即可.

练习册系列答案
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
19.下列说法不正确的是( )
| A. | Al箔插入稀HNO3中无现象因Al箔表面被HNO3氧化,形成致密的氧化膜 | |
| B. | 如图所示,①为AlCl3溶液,②中为浓氨水,①中有白色沉淀生成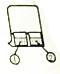 | |
| C. | Al2O3$\stackrel{NaOH(aq)}{→}$NaAlO2(aq)→Al(OH)3 | |
| D. | AlCl3溶液中滴加NaOH后铝元素的存在形式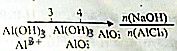 |
18.现有7瓶失去了标签的液体,可能是:①乙醇,②乙酸,③苯,④乙酸乙酯,⑤油脂,⑥葡萄糖溶液,⑦蔗糖溶液.现通过如表实验步骤来确定各试剂瓶中所装的液体名称.
试给它们的试剂瓶重新贴上标签:
B乙酸,D乙酸乙酯,E油脂,F葡萄糖,G蔗糖溶液.
| 实验步骤和方法 | 实验现象 |
| 1.把7瓶液体分别依次标号A、B、C、D、E、F、G后闻气味 | 只有F、G两种液体没有气味 |
| 2.各取少量于试管中加水稀释 | 只有C、D、E三种液体不溶解而浮在水上层 |
| 3.分别取少量7种液体于试管中加新制的Cu(OH)2悬浊液并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
| 4.各取C、D、E少量于试管中,加稀NaOH溶液并加热 | 只有C仍有分层现象,且E中发生了皂化反应 |
B乙酸,D乙酸乙酯,E油脂,F葡萄糖,G蔗糖溶液.
19.微波是一种高频电磁振荡.微波炉就是利用高频电磁振荡使食品中粒子也产生振荡而发热,现代医学上使用的微波手术刀进行外科手术,其好处主要是使开刀处血液迅速凝固而减少失血,以下关于其作用原理的说法正确的是( )
| A. | 微波电流迅速中和血液胶体所带的电荷而凝固 | |
| B. | 微波使局部血液受热而使血液胶体凝固 | |
| C. | 微波电流通过手术刀时产生的高温使血液凝固 | |
| D. | 以上说法都正确 |
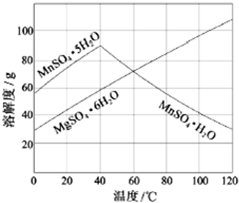 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2═MnSO4.
软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2═MnSO4. 如图是给病人输液用的氯化钠注射溶液的标签.
如图是给病人输液用的氯化钠注射溶液的标签. 工业制硫酸过程中,SO2催化氧化的原理为:2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g)△H<0.按照相同的物质的量投料,测得SO2在不同温度下的平衡转
工业制硫酸过程中,SO2催化氧化的原理为:2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g)△H<0.按照相同的物质的量投料,测得SO2在不同温度下的平衡转