题目内容
2.甲醇是一种重要的化工原料.(1)已知:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②H2O(l)═H2O(g)△H=+44.0kJ•mol-1
写出表示甲醇燃烧热的热化学方程式CH3OH(l)+$\frac{3}{2}$ O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol.
(2)甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.其反应为:
CH3OH (g)+H2O (g)?CO2(g)+3H2(g)△H=-72.0kJ/mol
①该反应的平衡常数表达式为$\frac{c(C{O}_{2}){c}^{3}({H}_{2})}{c(C{H}_{3}OH)c({H}_{2}O)}$.
②下列措施中能使平衡时n(CH3OH)/n(CO2)减小的是(双选)CD.
A.加入催化剂 B.恒容充入He(g),使体系压强增大
C.将H2(g)从体系中分离 D.恒容再充入1molH2O(g)
分析 (1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,结合热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)①平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
②为使甲醇与二氧化碳的物质的量比值增大,应使平衡向正反应方向移动,或增加甲醇的物质的量.
解答 解:(1)根据盖斯定律,将①-②×4可得:2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=(-1275.6kJ/mol)-(+44.0kJ/mol)×4=-1451.6kJ/mol,所以表示甲醇燃烧热的热化学方程式为:CH3OH(l)+3/2 O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol,
故答案为:CH3OH(l)+3/2 O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol;
(2)①CH3OH (g)+H2O (g)?CO2(g)+3H2(g)△H=-72.0kJ/mol,该反应的平衡常数表达式为K=$\frac{c(C{O}_{2}){c}^{3}({H}_{2})}{c(C{H}_{3}OH)c({H}_{2}O)}$,
故答案为:$\frac{c(C{O}_{2}){c}^{3}({H}_{2})}{c(C{H}_{3}OH)c({H}_{2}O)}$;
②CH3OH (g)+H2O (g)?CO2(g)+3H2(g),反应是气体体积增大的反应;
A、加入催化剂,平衡向不发生移动,甲醇与二氧化碳的物质的量比值不变,故A错误;
B、恒容充入He(g),使体系压强增大,分压不变,对反应物质没有影响,平衡不移动,二者比值不变,故B错误;
C、将H2(g)从体系中分离,生成物的浓度减小,平衡向正反应方向移动,二者比值变大,故C正确;
D、再充入1mol H2O,平衡向正方向移动,甲醇浓度增大,二者比值增大,故D正确.
故答案为:CD.
点评 本题考查了盖斯定律、化学平衡移动原理及平衡影响因素的分析判断,难度中等.

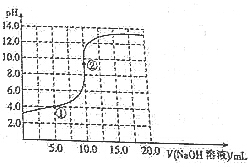 常温下,用0.1mol•L-1的NaOH溶液滴定10.0mL0.1mol•L-1的HA溶液,其滴定曲线如图所示,下列说法不正确的是( )
常温下,用0.1mol•L-1的NaOH溶液滴定10.0mL0.1mol•L-1的HA溶液,其滴定曲线如图所示,下列说法不正确的是( )| A. | HA是弱酸 | B. | ②处:c(H+)>c(OH-) | ||
| C. | ①处:c(Na+)=c(A-)+c(HA) | D. | ②处:c(Na+)=c(A-)+c(HA) |
| A. | 9.2g | B. | 4.6g | C. | 6.2g | D. | 10.6g |
| A. | Al箔插入稀HNO3中无现象因Al箔表面被HNO3氧化,形成致密的氧化膜 | |
| B. | 如图所示,①为AlCl3溶液,②中为浓氨水,①中有白色沉淀生成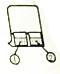 | |
| C. | Al2O3$\stackrel{NaOH(aq)}{→}$NaAlO2(aq)→Al(OH)3 | |
| D. | AlCl3溶液中滴加NaOH后铝元素的存在形式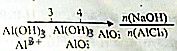 |
根据上述实验,请回答
| 操作 | 实验现象 | |
| ①第一份加入AgNO3溶液 | 有白色沉淀产生 | |
| ②第二份加入足量NaOH溶液,加热 | 收集到气体672mL(标准状况) | |
| ③第三份先加入足量BaCl2溶液,再向产生的沉淀中加入足量盐酸经洗涤、干燥后 | 先产生干燥沉淀6.63g, 之后沉淀变为4.66g | |
(2)请用离子方程式表示沉淀减少的原因BaCO3+2H+=Ba2++H2O+CO2↑.
(3)对于存在的且能定量计算出离子浓度,请写出它们的物质的量浓度:c(NH4+)=0.3mol•L-1,c(CO32-)=0.1mol•L-1,c(SO42-)=0.2mol•L-1 .