题目内容
9.“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
5 C+4 KMnO4+6 H2SO4→5CO2↑+4MnSO4+2K2SO4+6H2O;
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值<1 (填具体值或取值范围);
③实验4,若900℃时,在此容器中加入10molCO,5molH2O,2molCO2,5molH2,则此时V正<V逆(填“<”、“>”或“=”).
分析 (1)反应中C元素的化合价由0升高为+4价,Mn元素的化合价由+7价降低为+2价,结合化合价升降总数相等以及质量守恒定律配平;
(2)①先求得各物质平衡时的浓度,再根据平衡常数等于生成物浓度系数次幂之积除以反应物浓度系数次幂之积求得平衡常数;
②在反应中当反应物的物质的量之比等于化学计量数之比时,各反应物的转化率相等,某一种反应物越多,其转化率越低,而另一种反应物的转化率则越高,据此答题;
③根据浓度商Qc与平衡常数K的大小,判断反应进行的方向,进而确定正逆反应的速率.
解答 解:(1)反应中C元素的化合价由0升高为+4价,Mn元素的化合价由+7价降低为+2价,该反应中转移20e-,由电子守恒和质量守恒定律可知得化学反应为5C+4KMnO4+6HSO4=5CO2↑+4MnSO4+2K2SO4+6H2O,
故答案为:5;4;6;5;4;2;6;
(2)①CO(g)+H2O(g)?CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):0.8 0.8 0.8 0.8
平衡(mol):1.2 0.2 0.8 0.8
所以平衡常数K=$\frac{0.8×0.8}{1.2×0.2}$=2.67,故答案为:2.67;
②在反应中当反应物的物质的量之比等于化学计量数之比时,各反应物的转化率相等,某一种反应物越多,其转化率越低,而另一种反应物的转化率则越高,所以要使CO的转化率大于水蒸气,则0<$\frac{a}{b}$<1,故答案为:0<$\frac{a}{b}$<1;
③900℃时,当容器中加入10molCO,5molH2O,2molCO2,5molH2时,浓度商Qc=$\frac{1×2.5}{5×2.5}$=0.2<2.67=K,所以此时平衡要逆向移动,故V正<V逆,故答案为:<.
点评 本题主要考查了氧化还原反应的配平、化学平衡常数的计算、等知识点,综合性较强,中等难度,解题时注意对基础知识的灵活运用.


| A. | ①②中Mg作负极,③④中Fe作负极 | |
| B. | ②中Mg作正极,电极反应式为:2H2O+2e-═2OH-+H2↑ | |
| C. | ③中Fe作负极,电极反应式为Fe-2e-═Fe2+ | |
| D. | ④中Cu作正极,电极反应式为2H++2e-═H2↑ |
| A. | Al箔插入稀HNO3中无现象因Al箔表面被HNO3氧化,形成致密的氧化膜 | |
| B. | 如图所示,①为AlCl3溶液,②中为浓氨水,①中有白色沉淀生成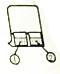 | |
| C. | Al2O3$\stackrel{NaOH(aq)}{→}$NaAlO2(aq)→Al(OH)3 | |
| D. | AlCl3溶液中滴加NaOH后铝元素的存在形式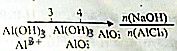 |
| A. | 10 min后向容器中加入A,再次达平衡时,A的转化率一定大于50% | |
| B. | 前10 min内反应的平均速率υ(C)=0.1 mol•L-1•min-1 | |
| C. | 恒温下,将压强变为原来的2倍,则再次达平衡时D的浓度小于1 mol•L-1 | |
| D. | 反应达平衡时c(B)=1.5 mol•L-1 |
| 实验步骤和方法 | 实验现象 |
| 1.把7瓶液体分别依次标号A、B、C、D、E、F、G后闻气味 | 只有F、G两种液体没有气味 |
| 2.各取少量于试管中加水稀释 | 只有C、D、E三种液体不溶解而浮在水上层 |
| 3.分别取少量7种液体于试管中加新制的Cu(OH)2悬浊液并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
| 4.各取C、D、E少量于试管中,加稀NaOH溶液并加热 | 只有C仍有分层现象,且E中发生了皂化反应 |
B乙酸,D乙酸乙酯,E油脂,F葡萄糖,G蔗糖溶液.
| A. | 微波电流迅速中和血液胶体所带的电荷而凝固 | |
| B. | 微波使局部血液受热而使血液胶体凝固 | |
| C. | 微波电流通过手术刀时产生的高温使血液凝固 | |
| D. | 以上说法都正确 |
 以天然气为原料合成甲醇常见的方法有水煤气法和目前正在开发的直接氧化法
以天然气为原料合成甲醇常见的方法有水煤气法和目前正在开发的直接氧化法