题目内容
1.为了探究化学反应中的能量变化,某同学设计了如下两个实验.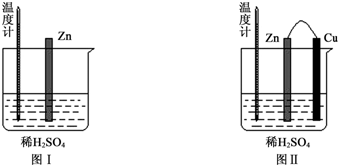
(1)图Ⅰ中发生反应的离子方程式为Zn+2H+═Zn2++H2↑,实验中温度计指示的温度逐渐升高(填“升高”或“降低”),原因是锌与稀硫酸反应是放热反应.
(2)图Ⅱ实验的实验现象如下表,请完成相应实验现象的解释.
| 实验现象 | 解释原因 |
| Cu片上产生了大量气泡 | Zn、Cu构成原电池,H+在Cu片上得电子产生氢气 |
| 温度计指示的温度无明显变化 | 反应中的化学能主要转化成了电能 |
分析 (1)锌和稀硫酸反应生成硫酸锌和氢气;稀硫酸和锌的反应是放热反应导致溶液温度逐渐升高;
(2)该装置构成原电池,Zn易失电子作负极,Cu作正极,正极上氢离子得电子生成氢气;温度计指示的温度变化不明显,说明化学能没有全部转化为热能,大多数转化为电能;
(3)如果将Cu替换为Al片,Al易失电子生成铝离子而作负极.
解答 解:(1)锌和稀硫酸反应生成硫酸锌和氢气,离子方程式为Zn+2H+═Zn2++H2↑;稀硫酸和锌的反应是放热反应导致溶液温度逐渐升高,化学能转化为热能;
故答案为:Zn+2H+═Zn2++H2↑;升高;锌与稀硫酸反应是放热反应;
(2)该装置构成原电池,Zn易失电子作负极,Cu作正极,正极上氢离子得电子生成氢气;温度计指示的温度变化不明显,说明化学能没有全部转化为热能,大多数转化为电能,
故答案为:Zn、Cu构成原电池,H+在Cu片上得电子产生氢气;反应中的化学能主要转化成了电能;
(3)如果将Cu替换为Al片,Al易失电子生成铝离子而作负极,电极反应式为Al-3e-═Al3,故答案为:Al-3e-═Al3+.
点评 本题考查原电池原理及离子方程式的书写,知道离子方程式书写规则及反应实质是解本题关键,知道正负极的判断方法,题目难度不大.

练习册系列答案
相关题目
11.存放食品和药品的包装盒中常可发现一些袋装透明胶状颗粒,该颗粒材料可能的名称及其作用是( )
| A. | 活性炭、吸附剂 | B. | KMnO4、氧化剂 | C. | 氯化钠、干燥剂 | D. | 硅胶、干燥剂 |
12.下列各组中的反应,属于同一反应类型的是( )
| A. | 乙醇和乙酸制乙酸乙酯;苯的硝化反应 | |
| B. | 乙烷和氯气制氯乙烷;乙烯与氯化氢反应制氯乙烷 | |
| C. | 葡萄糖与新制氢氧化铜共热;蔗糖与稀硫酸共热 | |
| D. | 乙醇和氧气制乙醛;苯和氢气制环己烷 |
9.下列含氧酸中酸性最强的是( )
| A. | H2SO4 | B. | HClO4 | C. | H3PO4 | D. | H2SeO4 |
16.下列化学反应的离子方程式正确的是( )
| A. | 在稀氨水中通入过量CO2:NH3•H2O+CO2═NH4++HCO3- | |
| B. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| C. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| D. | 等体积、等物质的量浓度的氢氧化钙溶液与稀硫酸混合:Ca2++OH-+H++SO42-═CaSO4↓+H2O |
6.下列物质属于弱电解质的是( )
| A. | CH3COOH | B. | NaOH | C. | SO2 | D. | NH4Cl |
11.下列说法错误的是( )
| A. | 电子排布式1s22s22p63s23p64s3违反了泡利原理 | |
| B. | 基态原子电子排布式1s22s22p63s23p63d5违反了能量最低原理 | |
| C. | 根据构造原理,原子核外电子填充顺序为1s2s2p3s3p4s3d4p5s5p4d6s4f5d6p | |
| D. | 某主族元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703…,当它与氯气反应时生成的阳离子是X2+ |
 羟基
羟基 羰基
羰基 酯基
酯基 醛基
醛基 羧基.
羧基.
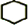 ,名称是环己烷.
,名称是环己烷. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$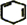 +2NaBr+2H2O.
+2NaBr+2H2O.