题目内容
16.下列化学反应的离子方程式正确的是( )| A. | 在稀氨水中通入过量CO2:NH3•H2O+CO2═NH4++HCO3- | |
| B. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| C. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| D. | 等体积、等物质的量浓度的氢氧化钙溶液与稀硫酸混合:Ca2++OH-+H++SO42-═CaSO4↓+H2O |
分析 A.在稀氨水中通入过量CO2,反应生成碳酸氢铵;
B.少量SO2通入Ca(ClO)2溶液中,发生氧化还原反应生成硫酸钙;
C.用稀HNO3溶解FeS固体,发生氧化还原反应生成硝酸铁、S、NO和水;
D.氢离子、氢氧根离子的系数错误,不满足硫酸、氢氧化钙的化学式组成.
解答 解:A.在稀氨水中通入过量CO2,反应生成碳酸氢铵,反应的离子反应为:NH3•H2O+CO2═NH4++HCO3-,故A正确;
B.少量SO2通入Ca(ClO)2溶液中,二者发生氧化还原反应,反应的离子反应为:SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl-,故B错误;
C.用稀HNO3溶解FeS固体,二者发生氧化还原反应,正确的离子反应为:NO3-+FeS+4H+═Fe3++S↓+NO↑+2H2O,故C错误;
D.氢氧化钙溶液与等物质的量的稀硫酸混合,反应生成硫酸钙和水,正确的离子方程式为:Ca2++2OH-+2H++SO42-=CaSO4↓+2H2O,故D错误;
故选A.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
6.在一定温度下,容积不变的密闭容器里,能说明A(g)+3B(g)?2C(g)达到平衡状态的标志是( )
| A. | 单位时间生成nmol A的同时生成3n mol | |
| B. | B.容器内压强不随时间的变化而变化 | |
| C. | A,B,C的浓度相等的状态 | |
| D. | A,B,C的分子个数比为1:3:2 |
7.乙烯与乙炔的混合气体100mL,加入300mL的O2,使之燃烧,生成的CO2在原条件下的体积(均为同温同压)是( )
| A. | 小于100 mL | B. | 200 mL | C. | 400 mL | D. | 无法确定 |
4.短周期主族元素X、Y、Z、W、Q的原子序数依次增大.X的气态氢化物极易溶于Y的氢化物中,常温下,Z的块状单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )
| A. | 元素Y的最高正化合价为+6 | |
| B. | 离子半径的大小顺序为W>Q>Z>X>Y | |
| C. | 气态氢化物的沸点:Y>W | |
| D. | 元素W的最高价氧化物对应的水化物酸性比Q的强 |
11.下列有关周期表的说法中,正确的是( )
| A. | 每个主族都含有非金属元素 | B. | 构成半导体的元素都是非金属元素 | ||
| C. | 过渡元素都属于金属元素 | D. | 非金属元素都位于短周期 |
1.为了探究化学反应中的能量变化,某同学设计了如下两个实验.
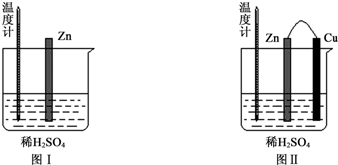
(1)图Ⅰ中发生反应的离子方程式为Zn+2H+═Zn2++H2↑,实验中温度计指示的温度逐渐升高(填“升高”或“降低”),原因是锌与稀硫酸反应是放热反应.
(2)图Ⅱ实验的实验现象如下表,请完成相应实验现象的解释.
(3)若将图中的Cu片替换为Al片,则Al片上的电极反应式为Al-3e-═Al3.

(1)图Ⅰ中发生反应的离子方程式为Zn+2H+═Zn2++H2↑,实验中温度计指示的温度逐渐升高(填“升高”或“降低”),原因是锌与稀硫酸反应是放热反应.
(2)图Ⅱ实验的实验现象如下表,请完成相应实验现象的解释.
| 实验现象 | 解释原因 |
| Cu片上产生了大量气泡 | Zn、Cu构成原电池,H+在Cu片上得电子产生氢气 |
| 温度计指示的温度无明显变化 | 反应中的化学能主要转化成了电能 |
8.图表示的是某物质所发生的( )


| A. | 置换反应 | B. | 电离过程 | C. | 中和反应 | D. | 水解反应 |
5.工业上从含硒的废液中提取硒的方法之一是:用硫酸和硝酸处理废料,获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸(2HCl+H2SeO4=H2SeO3+Cl2↑+H2O),在亚硒酸溶液中通入SO2,有单质硒析出.下列说法错误的是( )
| A. | 氧化性:H2SeO4>Cl2;H2SeO3>H2SO4 | |
| B. | 酸性:H2SO4>H2SeO4>H2SeO3 | |
| C. | 析出l mol硒需要消耗标准状况下22.4 L SO2 | |
| D. | 亚硒酸理论上既有氧化性,又有还原性,但还原性不及亚硫酸 |
6.短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外电子层电子数之比为4:3,Z原子比X原子的核外电子数多4.下列说法正确的是( )
| A. | W、Y、Z的电负性大小顺序一定是Z>Y>W | |
| B. | W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z | |
| C. | Y、Z形成的分子的空间构型可能是正四面体 | |
| D. | 若有WY2,则WY2分子中σ键与π键的数目之比是2:1 |