题目内容
9.下列含氧酸中酸性最强的是( )| A. | H2SO4 | B. | HClO4 | C. | H3PO4 | D. | H2SeO4 |
分析 元素的非金属性越强,其最高价氧化物的水化物酸性越强,据此分析解答.
解答 解:元素的非金属性越强,其最高价氧化物的水化物酸性越强,S、Cl、P、Se元素的非金属性最强的是Cl元素,所以最高价氧化物的水化物酸性最强的是,故选B.
点评 本题考查最高价氧化物的水化物酸性强弱判断,明确非金属的非金属性与其最高价氧化物的水化物酸性强弱关系是解本题关键,熟悉非金属性强弱判断方法,题目难度不大.

练习册系列答案
相关题目
19.用惰性电极实现电解,下列说法正确的是( )
| A. | 电解稀硫酸溶液,实质上是电解水,故溶液的pH不变 | |
| B. | 电解稀氢氧化钠溶液,要消耗OH-,故溶液的pH减小 | |
| C. | 电解氯化钾溶液,在阴极上和阳极上析出的产物的物质的量之比为1:1 | |
| D. | 电解硫酸钠溶液,在阴极上和阳极上析出的产物的物质的量之比为1:2 |
20.高纯晶体硅是信息技术的关键材料.
(1)硅元素位于周期表的位置第三周期第ⅣA族.下面有关硅材料的说法中正确的是BCD(填字母).
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料---光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,故在玻璃尖口点燃H2时出现黄色火焰
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
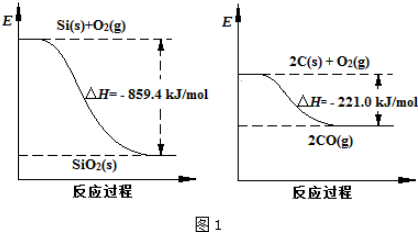
(2)工业上用石英砂和焦炭可制得粗硅.已知:图1
请将以下反应的热化学方程式补充完整:SiO2(s)+2C(s)═Si(s)+2CO(g)△H=+638.4 kJ•mol-1
(3)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅.已知硅烷的分解温度远低于甲烷,用原子结构解释其原因:C和Si最外层电子数相同,C原子半径小于Si,Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷.
(4)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅.
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响.根据下表数据,可用蒸馏(或分馏) 方法提纯SiHCl3.
②用SiHCl3制备高纯硅的反应为SiHCl3(g)+H2(g) $\stackrel{一定条件下}{?}$Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图所示.下列说法正确的是ac(填字母序号).
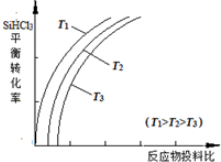
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是$\frac{n(SiHC{l}_{3})}{n({H}_{2})}$
c.实际生产中为提高SiHCl3的利用率,应适当升高温度
③整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:SiHCl3+3H2O═H2SiO3↓+H2↑+3HCl↑.

(1)硅元素位于周期表的位置第三周期第ⅣA族.下面有关硅材料的说法中正确的是BCD(填字母).
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料---光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,故在玻璃尖口点燃H2时出现黄色火焰
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(2)工业上用石英砂和焦炭可制得粗硅.已知:图1
请将以下反应的热化学方程式补充完整:SiO2(s)+2C(s)═Si(s)+2CO(g)△H=+638.4 kJ•mol-1
(3)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅.已知硅烷的分解温度远低于甲烷,用原子结构解释其原因:C和Si最外层电子数相同,C原子半径小于Si,Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷.
(4)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅.
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响.根据下表数据,可用蒸馏(或分馏) 方法提纯SiHCl3.
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |

a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是$\frac{n(SiHC{l}_{3})}{n({H}_{2})}$
c.实际生产中为提高SiHCl3的利用率,应适当升高温度
③整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:SiHCl3+3H2O═H2SiO3↓+H2↑+3HCl↑.
4.短周期主族元素X、Y、Z、W、Q的原子序数依次增大.X的气态氢化物极易溶于Y的氢化物中,常温下,Z的块状单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )
| A. | 元素Y的最高正化合价为+6 | |
| B. | 离子半径的大小顺序为W>Q>Z>X>Y | |
| C. | 气态氢化物的沸点:Y>W | |
| D. | 元素W的最高价氧化物对应的水化物酸性比Q的强 |
14.下列排列顺序不正确的是( )
| A. | 离子半径:Mg2+>O2->F- | B. | 原子半径:Na>S>O | ||
| C. | 热稳定性:HF>HCl>HBr | D. | 酸性:HClO4>H2SO4>H3PO4 |
1.为了探究化学反应中的能量变化,某同学设计了如下两个实验.
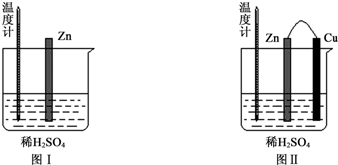
(1)图Ⅰ中发生反应的离子方程式为Zn+2H+═Zn2++H2↑,实验中温度计指示的温度逐渐升高(填“升高”或“降低”),原因是锌与稀硫酸反应是放热反应.
(2)图Ⅱ实验的实验现象如下表,请完成相应实验现象的解释.
(3)若将图中的Cu片替换为Al片,则Al片上的电极反应式为Al-3e-═Al3.

(1)图Ⅰ中发生反应的离子方程式为Zn+2H+═Zn2++H2↑,实验中温度计指示的温度逐渐升高(填“升高”或“降低”),原因是锌与稀硫酸反应是放热反应.
(2)图Ⅱ实验的实验现象如下表,请完成相应实验现象的解释.
| 实验现象 | 解释原因 |
| Cu片上产生了大量气泡 | Zn、Cu构成原电池,H+在Cu片上得电子产生氢气 |
| 温度计指示的温度无明显变化 | 反应中的化学能主要转化成了电能 |
18.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 除去苯中混有的少量苯酚:加入适量浓溴水,振荡、静置后过滤 | |
| B. | 0.5 mol NH4HSO4晶体中,含有H+数目约为0.5 NA | |
| C. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+) | |
| D. | 检验卤代烃中的卤原子:取足量液体与NaOH溶液共热后,再滴加AgNO3溶液 |
19.下列说法中正确的是( )
| A. | 沸点:PH3>NH3>H2O | |
| B. | CO2分子中的化学键为非极性键 | |
| C. | NH3分子中N原子的杂化轨道类型是sp2 | |
| D. | NH4+为正四面体结构,可推测出PH4+也为正四面体结构 |
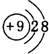 ,元素g的简单离子的结构示意图为
,元素g的简单离子的结构示意图为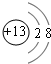 ,二者的离子半径大小顺序为F->Al3+.
,二者的离子半径大小顺序为F->Al3+.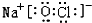 ,该化合物中所含的化学键类型为离子键、共价键.
,该化合物中所含的化学键类型为离子键、共价键.