题目内容
【题目】将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g).若经2s后测得C的浓度为0.6molL﹣1 , 现有下列几种说法:其中正确的是( ) ①用物质A表示的反应的平均速率为0.3molL﹣1s﹣1
②用物质B表示的反应的平均速率为0.6molL﹣1s﹣1
③2s时物质B的浓度为0.7molL﹣1
④2s末,物质A的转化率为70%
A.①④
B.①③
C.②④
D.③④
【答案】B
【解析】解:将 4mol A 气体和 2mol B 气体在 2L 的密闭容器中混合并在一定条件下发生如下反应 2A(g)+B(g)2C(g),若经 2s(秒)后测得 C 的浓度为0.6molL﹣1s﹣1 ,依据化学平衡三段式列式计算
2A(g)+ | B(g) | 2C(g) | |
起始(mol) | 4 | 2 | 0 |
转化(mol) | 1.2 | 0.6 | 1.2 |
平衡(mol) | 2.8 | 1.4 | 2L×0.6mol/L=1.2mol |
①2s后测得A的浓度为0.6molL﹣1,则v(A)= ![]() =0.3mol/(Ls),故①正确;
=0.3mol/(Ls),故①正确;
②用物质B表示反应的平均速率= ![]() mol/(Ls)=0.15mol/(Ls),故②错误;
mol/(Ls)=0.15mol/(Ls),故②错误;
③2s末物质B的浓度= ![]() =0.7molL﹣1;故③正确;
=0.7molL﹣1;故③正确;
④2s末物质A的转化率= ![]() ×100%=30%;故④错误;
×100%=30%;故④错误;
故选B.
【考点精析】本题主要考查了化学平衡的计算的相关知识点,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.

【题目】工业上用铬铁矿(主要成分可表示为FeO·Cr2O3,还含有Al2O3、MgCO3、SiO2等杂质)为原料制备重铬酸钾晶体(K2Cr2O7)和铁红的流程如下:
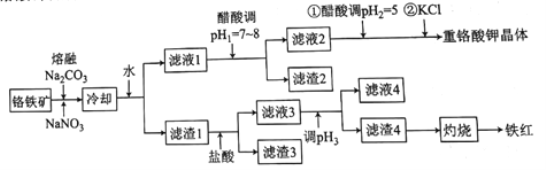
已知:I.常见离子开始生成沉淀和沉淀完全的pH如下表所示:
Fe3+ | Al3+ | Mg2+ | SiO32- | AlO2- | |
开始沉淀的pH | 1.9 | 4.2 | 8.1 | 9.5 | 10.2 |
沉淀完全的pH | 3.2 | 5.3 | 9.4 | 8.0 | 8.5 |
II.熔融Na2CO3条件下主要发生反应:
2FeO·Cr2O3+4Na2CO3+7NaNO3=4Na2CrO4+Fe2O3+4CO2↑+7NaNO2。
(1)熔融Na2CO3条件下还可以得到的副产物为NaAlO2和Na2SiO3,生成这两种副产物的化学方程式为___________________。
(2)滤渣2的主要成分为________(填化学式)。
(3)用醋酸调节pH2=5的目的为__________;若调节的pH过低,NO2-可被氧化为NO3-,其离子方程式为______________。
(4)调节pH2后,加入KCl控制一定条件,可析出K2Cr2O7晶体的可能理由是_______。
(5)调节pH3的范围为______。
(6)检验滤液4中Fe3+是否沉淀完全的方法是____________。
【题目】某化学兴趣小组要完成中和热的测定.
(1)实验桌上备有大小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、量筒、0.5molL﹣1盐酸、0.55molL﹣1NaOH溶液,实验尚缺少的玻璃用品是 .
(2)①实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?(填“能”或“否”),其原因是 . ②在大、小烧杯之间填满碎泡沫塑料的作用是 .
(3)他们记录的实验数据如表:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | △H | |||
① | 50 mL 0.55 molL﹣1 NaOH溶液 | 50 mL 0.5 molL﹣1 HCl溶液 | 20℃ | 23.3℃ | kJ/mol |
② | 50 mL 0.55 molL﹣1 NaOH溶液 | 50 mL 0.5 molL﹣1 HCl溶液 | 20℃ | 23.5℃ | |
已知:反应后溶液的比热容c为4.18kJ℃﹣1kg﹣1 , 各物质的密度均为1gcm﹣3 . 计算完成上表(保留两位小数).
(4)实验分析 ①若用醋酸代替HCl做实验,测得的中和热的数值(填“偏大”或“偏小”或“无影响”).
②若用60mL 0.5molL﹣1HCl溶液与50mL 0.55molL﹣1NaOH溶液完成实验,与上述实验相比,测得反应放出的热量(填“偏大”或“偏小”或“不变”),中和热(填“偏大”或“偏小”或“不变”)