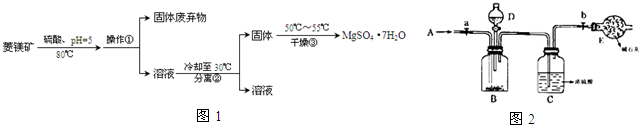
题目内容
6.在相同条件下,下列各组中的物质按熔点由高到低排列的是( )| A. | 干冰、冰、金属钠 | B. | 二氧化硅、食盐、硫 | ||
| C. | 金刚石、碘、氧化钙 | D. | HF、HCl、HBr |
分析 一般情况下,不同类型的晶体,熔点:原子晶体>离子晶体>金属晶体>分子晶体;同种类型的晶体可根据影响晶体的因素分析.
解答 解:A.干冰为分子晶体,常温下为气体,熔点最低,故A错误;
B.二氧化硅为原子晶体,硫为分子晶体,食盐为离子晶体,则熔点:二氧化硅>食盐>硫,故B正确;
C.金刚石为原子晶体,碘为分子晶体,氧化钙为离子晶体,则熔点:金刚石>氧化钙>碘,故C错误;
D.HF、HCl、HBr都为同主族元素所形成的分子晶体,分子的相对分子质量越大,分子间作用力越大,分子间含有氢键的沸点最高,应为HF>HBr>HCl,故D错误.
故选B.
点评 本题考查晶体的熔沸点高低的比较,题目难度不大,注意比较晶体熔沸点高低的角度.

练习册系列答案
相关题目
14.下列离子方程式正确的是( )
| A. | 稀硫酸滴在镁片上:Mg+2H+═Mg2++H2↑ | |
| B. | 硫酸镁溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 硝酸银溶液与盐酸反应:Ag++Cl-═AgCl↓ | |
| D. | 澄清石灰水与碳酸钠溶液反应:Ca(OH)2+CO32-═CaCO3↓+H2O |
11.下列关于卤素的叙述正确的是( )
| A. | 卤素有单质存在于自然界中 | |
| B. | 随核电荷数增加,单质熔沸点升高 | |
| C. | 随核电荷数增加,单质氧化性增强 | |
| D. | 单质与水反应,均可用通式X2+H2O═HX+HXO表示 |
18.下列互为同位素的一组是( )
| A. | 氕、氘、氚 | B. | 白磷、红磷 | C. | 金刚石、石墨、C60 | D. | O2、O3 |