题目内容
4.锂~碘电池可用来为心脏起搏器提供能源,其电池反应可表示为:2Li+I2→2LiI.下列有关说法错误的是( )| A. | 放电时化学能转化为电能 | B. | 负极反应为:Li-e=Li+ | ||
| C. | 正极反应为:I2+2e-=2I- | D. | 电流由负极流向正极 |
分析 分析反应的化合价变化,可得Li为还原剂,I2为氧化剂,负极材料为Li(还原剂),发生氧化反应,电极反应式为Li-e-=Li+,正极发生还原反应,电极方程式为:I2+2e→2I-,原电池中电子从负极流向正极;据此分析.
解答 解:A.该装置为原电池,原电池是把化学能转化为电能装置,故A正确;
B.Li为还原剂,为原电池的负极,电极反应式为Li-e-=Li+,故B正确;
C.正极发生还原反应,电极方程式为:I2+2e→2I-,故C正确;
D.电池工作时,电流通过外电路从正极流向负极,故D错误.
故选D.
点评 本题考查原电池知识,题目难度不大,本题注意根据反应的总方程式判断反应的变化为解答该题的关键,答题中注意电极的判断和电极反应式的书写.

练习册系列答案
 能力评价系列答案
能力评价系列答案
相关题目
14.下列离子方程式正确的是( )
| A. | 稀硫酸滴在镁片上:Mg+2H+═Mg2++H2↑ | |
| B. | 硫酸镁溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 硝酸银溶液与盐酸反应:Ag++Cl-═AgCl↓ | |
| D. | 澄清石灰水与碳酸钠溶液反应:Ca(OH)2+CO32-═CaCO3↓+H2O |
15.已知:(1)胆矾失水的热化学方程式为:CuSO4•5H2 O(s)═CuSO4 (s)+5H2 O(l)△H=+Q 1 kJ/mol
(2)室温下,无水硫酸铜溶于水的热化学方程式为:CuSO4 (s)═Cu2+(aq)+SO4 2-(aq)△H=-Q 2 kJ•mol- 1
(3)胆矾(CuSO4•5H2O)溶于水时溶液温度降低.则Q1与Q2的关系是( Q1、Q2为正数)( )
(2)室温下,无水硫酸铜溶于水的热化学方程式为:CuSO4 (s)═Cu2+(aq)+SO4 2-(aq)△H=-Q 2 kJ•mol- 1
(3)胆矾(CuSO4•5H2O)溶于水时溶液温度降低.则Q1与Q2的关系是( Q1、Q2为正数)( )
| A. | Q 1>Q 2 | B. | Q 1=Q 2 | C. | Q 1<Q 2 | D. | 无法确定 |
12.下列离子方程式书写正确的是( )
| A. | 钠投入水中:Na+H2O=Na++OH-+H2↑ | |
| B. | 实验室利用熟石灰和氯化铵制备氨气:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | Fe3O4与稀硝酸反应:Fe3O4+8H+=2Fe3++Fe2++4H2O | |
| D. | 20mL0.2mol•L-1FeBr2溶液与0.004mol的Cl2反应:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 |
9.下列各组中的离子,能在溶液中大量共存的是( )
| A. | H+,Ca2+,Cl-,CO32- | B. | Na+,Fe3+,OH-,SO42- | ||
| C. | K+,Na+,OH-,Cl- | D. | Cu2+,Ba2+,Cl-,SO42- |
13.X、Y、Z、W为四种短周期主族元素.其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6.下列说法正确的是( )
| A. | Y、Z两元素的简单离子的半径Y>Z | |
| B. | Y元素最高价氧化物对应水化物的化学式为H2YO4 | |
| C. | 原子序数由小到大的顺序为W<X<Y<Z | |
| D. | X与W可以形成W2X、W2X2两种化合物 |
14.下列装置能形成原电池且灵敏电流计发生偏转的是( )
| A. | 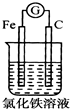 | B. | 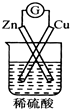 | C. |  | D. | 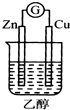 |