题目内容
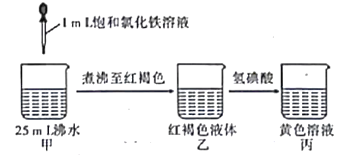
【题目】某研究性学习小组为探究铜片与浓H2SO4反应及产物的化学性质,设计了如图实验装置。请回答下列问题:
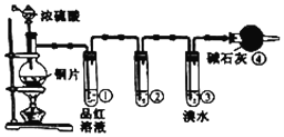
(1)图中仪器a的名称:______。装置④的作用是______。
(2)写出铜片与浓H2SO4共热发生反应的化学方程式:______。
(3)为了验证SO2是酸性氧化物,试管②中可选择的试剂是______![]() 填序号
填序号![]() 。
。
a、酸性KMnO4溶液 b、紫色石蕊试液 c、Na2S溶液
(4)下列说法正确的是______。
A.先检査装置的气密性,再向装置中加入药品
B.实验开始时,只需打开分液漏斗的旋塞,即可使液体顺利滴下
C.实验开始后,试管①和③溶液均褪色,两者均可证明SO2具有漂白性
【答案】分液漏斗 吸收尾气,防止污染环境 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O b A
CuSO4+SO2↑+2H2O b A
【解析】
铜和浓硫酸反应生成SO2,SO2具有漂白性,能够使品红溶液褪色;SO2能与I2反应,化合价升高生成H2SO4,利用碱石灰,吸收SO2。
(1)图中仪器a的名称为分液漏斗;装置④中为碱石灰,能够吸收SO2,防止污染环境,因此其作用是吸收尾气,防止污染环境;
(2)铜片与浓H2SO4共热发生反应的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(3)为了验证SO2是酸性氧化物,SO2与水反应生成H2SO3,能够使紫色石蕊试液变红;SO2能使酸性KMnO4溶液褪色,体现SO2的还原性;SO2与Na2S反应生成S单质,体现SO2的氧化性,故答案为:b;
(4)A.反应生成气体,则先检査装置的气密性,再向装置中加入药品,故A正确;
B.实验开始时,只需打开分液漏斗的旋塞,还需要打开上部的塞子,利用压强使液体顺利滴下,故B错误;
C.实验开始后,试管①和③溶液均褪色,前者证明SO2具有漂白性,后者证明其还原性,故C错误;
答案为A。

 53随堂测系列答案
53随堂测系列答案【题目】某蓄电池的反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
(1)该蓄电池放电时,发生还原反应的物质是________;
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常在船体上镶嵌Zn块,或与该蓄电池的_____ (填“正”或“负”)极相连。
(3)精炼铜时,粗铜应与直流电源的________(填“正”或“负”)极相连。精炼过程中,电解质溶液中的c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。甲同学设计如下除杂方案:
![]()
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀时的pH | 2.3 | 7.5 | 5.6 |
完全沉淀时的pH | 3.9 | 9.7 | 6.4 |
①实验操作I的名称________ 则加入H2O2的目的是____________________。
②乙同学认为应将方案中的pH调节到8,你认为此观点_____(填“正确”或“不正确”),理由是_________。
(4)该蓄电池充电时阴极的电极反应式为_________________。