题目内容
【题目】下列图示与对应的叙述相符的是
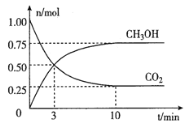
A. 图 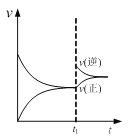 可表示N2+3H2
可表示N2+3H2![]() 2NH3的速率时间图像,t1时刻改变的条件是升高温度
2NH3的速率时间图像,t1时刻改变的条件是升高温度
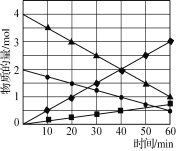
B. 图 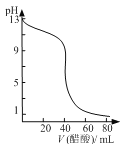 可表示用0.1000 mol·L-1醋酸滴定40.00mL 0.1000mol·L-1NaOH溶液得到的滴定曲线
可表示用0.1000 mol·L-1醋酸滴定40.00mL 0.1000mol·L-1NaOH溶液得到的滴定曲线
C. 图 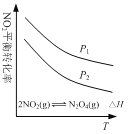 可表示NO2平衡转化率与温度、压强的变化关系,由图可知:△H<0、P1<P2
可表示NO2平衡转化率与温度、压强的变化关系,由图可知:△H<0、P1<P2
D. 图 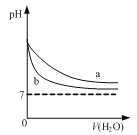 可表示pH相同的NaOH溶液与氨水稀释过程的pH变化,其中曲线a对应氨水
可表示pH相同的NaOH溶液与氨水稀释过程的pH变化,其中曲线a对应氨水
【答案】D
【解析】
试题A、升高温度正逆反应速率均增大,错误;B、醋酸是弱电解质,0.1 000 mol/L醋酸的pH大于1,而且滴定时突变曲线比较平缓,错误;C、图像中有多个变量时要注意定一议一,随温度升高,NO2平衡转化率降低,平衡逆向移动,正向为放热反应,△H<0;相同温度下,压强大平衡正向移动,NO2平衡转化率增大,故P2<P1,错误;D、氨水是弱电解质,加水稀释过程中不断电离产生OH-,使得氨水的pH高于加同样水的氢氧化钠溶液,但随水的量的增加,pH无限接近7,正确。

练习册系列答案
相关题目