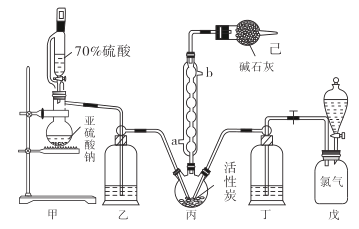
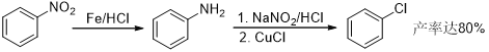题目内容
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2 ![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是
A. 组别①中,0~20min内,NO2的降解速率为0.0125 mol·L-1·min-1
B. 由实验数据可知实验控制的温度T12
C. 40min时,表格中T2应填的数据为0.18
D. 0~10min内,CH4的降解速率①>②
【答案】B
【解析】A、随着反应的进行,反应物的浓度降低,反应速率减小,故组别①中,0~20min内,NO2的降解平均速率为0.0125 mol·L-1·min-1,选项A错误;B、温度越高反应速率越大,达平衡所需时间越短,由实验数据可知实验控制的温度T1<T2,选项B正确;C、 40min时,表格中T2应的数据为0.15-0.18之间,选项C错误;D、 0~10min内,CH4的降解速率②>①,选项D错误。答案选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目