题目内容
3.下列各组数据中,前者一定比后者大的是( )| A. | 常温下pH相同的KOH溶液和K2CO3溶液中由水电离出的c(OH-) | |
| B. | 浓度均为0.1mol•L-1的(NH4)2CO3溶液和(NH4)2SO4溶液中的c(NH4+) | |
| C. | 3 L 0.1 mol•L-1CH3COOH溶液和1L 0.3 mol•L-1CH3COOH溶液中的H+离子数 | |
| D. | 中和pH与体积均相同的NaOH溶液和氨水,所消耗H2SO4的物质的量 |
分析 A.根据水的电离程度分析,酸或碱抑制水电离,含有弱根离子的盐能促进水电离;
B.醋酸根离子水解,促进了铵根离子的水解;
C.醋酸浓度越小,醋酸的电离程度越小;
D.氨水为弱碱,氨水浓度大于氢氧化钠,消耗硫酸的物质的量前者小于后者.
解答 解:A.常温下,氢氧化钾抑制水电离,K2CO3促进水电离,所以pH相同的KOH溶液小于K2CO3溶液中由水电离出的OH-离子浓度,故A错误;
B.浓度均为0.1mol•L-1的(NH4)2CO3溶液和(NH4)2SO4溶液中,碳酸铵溶液中碳酸根离子水解促进了铵根离子的水解,则碳酸铵溶液中的铵根离子浓度小于硫酸铵,故B错误;
C.两溶液中醋酸的物质的量相等,而醋酸浓度越大,电离程度越小,则前者溶液中氢离子的物质的量大于后者,故C正确;
D.中和pH与体积均相同的NaOH溶液和氨水,氨水为弱碱,则氨水浓度大于氢氧化钠,故氨水消耗的硫酸的物质的量大,故D错误;
故选C.
点评 本题考查了弱电解质的电离,题目难度中等,注意掌握弱电解质的电离平衡及其影响因素,易错选项是A,注意酸或碱抑制水电离,含有弱根离子的盐促进水电离.

练习册系列答案
相关题目
13.下列说法正确的是( )
| A. | O3是氧的一种同位素,其中含有共价键,属于共价化合物 | |
| B. | NaOH、HNO3中都含有离子键和共价键 | |
| C. | 235U、238U是两种不同核素,属于同一种元素 | |
| D. | 已知石墨合成金刚石是吸热反应,金刚石比石墨稳定 |
14.苯与乙烯相比较,下列叙述正确的是( )
| A. | 都容易发生取代反应 | B. | 都能被酸性KMnO4氧化 | ||
| C. | 苯不能发生加成反应 | D. | 都能在空气中燃烧 |
11.短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10,A与C同主族,B原子最外层电子数等于A原子次外层电子数,则下列叙述正确的是( )
| A. | 原子半径A<B<C | |
| B. | A与C可形成离子化合物 | |
| C. | A的氧化物熔点比B的氧化物高 | |
| D. | B单质可与A的最高价氧化物发生置换反应 |
18.在下列反应中,化学式下面画有短线的物质只作氧化剂的是( )
| A. | 2NH3+3Cl2═N2+6HCl | B. | 2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$ N2+3Cu+3H2O | ||
| C. | Cl2+2NaOH═NaCl+NaClO+H2O | D. | KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O |
15.根据下表(部分短周期元素的原子半径及主要化合价)信息,判断以下叙述正确的是( )
| 元素代号 | A | B | C | D | E | F |
| 原子半径/nm | 0.186 | 0.143 | 0.160 | 0.102 | 0.074 | 0.099 |
| 主要化合价 | +l | +3 | +2 | +6、-2 | -2 | +7、-1 |
| A. | 元素D位于第三周期Ⅵ族 | |
| B. | A、B、C三种元素的最高价氧化物对应水化物的碱性依次增强 | |
| C. | 1mol F的单质参加氧化还原反应时转移的电子数一定为2 mol | |
| D. | 元素B、E形成的化合物具有两性 |
13.NA表示阿伏伽德罗常数,则下列叙述中,正确的是( )
| A. | 32g S2-中电子数目为2NA | |
| B. | 46g NO2和N2O4的混合物中含有的原子数为3NA | |
| C. | 1L 0.5mol•L-1 Na2CO3溶液中含有的CO32-数为0.5NA | |
| D. | 78g Na2O2中阴离子数目为2NA |
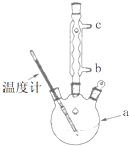 (1)阿司匹林是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程(略).
(1)阿司匹林是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程(略). .
.