题目内容
11.短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10,A与C同主族,B原子最外层电子数等于A原子次外层电子数,则下列叙述正确的是( )| A. | 原子半径A<B<C | |
| B. | A与C可形成离子化合物 | |
| C. | A的氧化物熔点比B的氧化物高 | |
| D. | B单质可与A的最高价氧化物发生置换反应 |
分析 短周期元素A、B、C的原子序数依次递增,A与C同主族,B原子最外层电子数等于A原子次外层电子数,则A元素含有2个电子层,则B原子最外层电子数为2,三元素原子的最外层电子数之和为10,则A、C最外层电子数为$\frac{10-2}{2}$=4,故A为碳元素、C为Si,则B为Mg,据此解答.
解答 解:短周期元素A、B、C的原子序数依次递增,A与C同主族,B原子最外层电子数等于A原子次外层电子数,则A元素含有2个电子层,则B原子最外层电子数为2,三元素原子的最外层电子数之和为10,则A、C最外层电子数为$\frac{10-2}{2}$=4,故A为碳元素、C为Si,则B为Mg.
A.同主族电子层数越多原子半径越大,同一周期从左到右原子半径逐渐减小,则半径关系为A(C)<C(Si)<B(Mg),故A错误;
B.碳与硅形成化合物为共价化合物,故B错误;
C.A的氧化物为CO或CO2,属于分子晶体,熔点比B的氧化物为MgO,属于离子晶体,熔点高于CO或CO2,故C错误;
D.B单质可与A的最高价氧化物发生置换反应:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,故D正确,
故选:D.
点评 本题考查位置结构性质的关系,推断元素是解题关键,注意对基础知识积累掌握.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
1.化学与资源、环境、生活关系密切,下列说法正确的是( )
| A. | 燃烧汽油产生的汽车尾气中所含的大气污染物主要是CO,NO、SO2、CO2等 | |
| B. | 乙醇、次氯酸钠溶液均可以将病毒氧化而消毒 | |
| C. | 用纯碱溶液清洗餐具上的油污时,加热可以提高去污能力 | |
| D. | 火力发电是将化学能直接转化为电能 |
2.下列化学用语和描述均正确的是( )
| A. | 钙原子的结构示意图: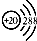 | |
| B. | 结构简式为CH2CH2的分子可发生加成反应 | |
| C. | 符号为${\;}_{8}^{18}$O的原子常用于文物年代的测定 | |
| D. | 电子式分别为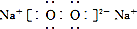 和 和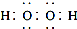 的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |
19.关于下列实验,说法正确的是( )
| A. | 将一块铝片投入足量NaOH溶液中,充分反应后铝片消失,将溶液蒸干便可得到纯净NaAlO2 | |
| B. | 将二块相同铝片投入到等物质的量浓度的CuSO4和CuCl2溶液中,反应速率几乎相同 | |
| C. | 将铝粉投入浓NaOH溶液中,1mol铝可还原3mol水 | |
| D. | 将一小块钠投入盛有乙醇的烧杯中,由于钠的密度大于乙醇,所以钠一直在液面下反应 |
16.1905年德国化学家哈伯发明了合成氨的方法.他因此获得了1918年度诺贝尔化学奖.哈伯法合成氨需要在20-50MPa的高压和500℃的高温下,用铁作催化剂,且氨转化率10%-15%.2005年6月27日美国化学会刊报道,美国俄勒冈大学的化学家使用了一种名为transFe(DMeOPrPE)2Cl2的铁化合物.用transFe(DMeOPrPE)2Cl2作催化剂,在常温常压下合成出氨,反应可表示为N2+3H2$\stackrel{催化剂}{?}$2NH3,有关说法正确的是( )
| A. | 不同的催化剂对化学反应速率影响均相同 | |
| B. | 新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展远景 | |
| C. | 新法合成能在常温下进行是因为不需要断裂化学键 | |
| D. | 哈伯法合成氨是吸热反应,新法合成氨是放热反应 |
3.下列各组数据中,前者一定比后者大的是( )
| A. | 常温下pH相同的KOH溶液和K2CO3溶液中由水电离出的c(OH-) | |
| B. | 浓度均为0.1mol•L-1的(NH4)2CO3溶液和(NH4)2SO4溶液中的c(NH4+) | |
| C. | 3 L 0.1 mol•L-1CH3COOH溶液和1L 0.3 mol•L-1CH3COOH溶液中的H+离子数 | |
| D. | 中和pH与体积均相同的NaOH溶液和氨水,所消耗H2SO4的物质的量 |
