题目内容
12.为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验.(1)若取a g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为b L.样品中铝的质量是$\frac{9b}{11.2}$g.
(2)若取a g样品将其点燃,恰好完全反应,该反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3氧化铁与铝的质量比是80:27.
(3)待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体体积为c L,该气体与(1)中所得气体的体积比c:b=2:3.
分析 (1)氧化铁和氢氧化钠溶液不反应,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,根据氢气的体积计算铝的质量;
(2)铝与氧化铁在高温下生成铁与氧化铝;由二者恰好反应,根据方程式可知,质量之比等于总的相对分子质量之比;
(3)由方程式可知,(2)中生成的n(Fe)等于铝热剂中n(Al),与盐酸反应生成的氢气体积之比等于金属提供的电子的物质的量之比.注意铁与盐酸反应生成氯化亚铁.
解答 (1)氧化铁和氢氧化钠溶液不反应,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,根据方程式知,铝的质量=$\frac{bL}{22.4L/mol}$×27g/mol=$\frac{9b}{11.2}$g,
故答案为:$\frac{9b}{11.2}$;
(2)铝与氧化铁在高温下生成铁与氧化铝,反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;由二者恰好反应,根据方程式可知,
质量之比等于总的相对分子质量之比,则样品中氧化铁与铝的质量比为(56×2+16×3):2×27=80:27,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,80:27;
(3)由方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3可知,(2)中生成的n(Fe)等于铝热剂中n(Al),与盐酸反应生成的氢气体积之比等于金属提供的电子的物质的量之比,所以(3)中生成的氢气与(1)中生成氢气体积之比c:b=2n(Fe):3n(Al)=2:3,
故答案为:2:3.
点评 本题考查铝热反应原理及混合物反应的计算,题目难度中等,明确铝热反应原理为解答关键,注意铁与稀盐酸反应生成的是亚铁离子,为易错点,试题培养了学生的分析能力及化学实验、化学计算能力.

| A. | 钙原子的结构示意图: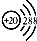 | |
| B. | 结构简式为CH2CH2的分子可发生加成反应 | |
| C. | 符号为${\;}_{8}^{18}$O的原子常用于文物年代的测定 | |
| D. | 电子式分别为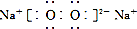 和 和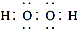 的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |
| A. | 常温下pH相同的KOH溶液和K2CO3溶液中由水电离出的c(OH-) | |
| B. | 浓度均为0.1mol•L-1的(NH4)2CO3溶液和(NH4)2SO4溶液中的c(NH4+) | |
| C. | 3 L 0.1 mol•L-1CH3COOH溶液和1L 0.3 mol•L-1CH3COOH溶液中的H+离子数 | |
| D. | 中和pH与体积均相同的NaOH溶液和氨水,所消耗H2SO4的物质的量 |
| A. | 干冰、铁、氯化氢 | B. | 空气、液氨、胆矾 | ||
| C. | 冰水混合物、烧碱、氯化钠 | D. | 盐酸、氧化铁、二氧化硫 |
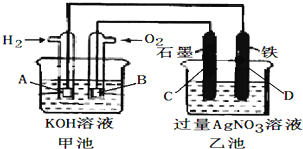
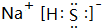 .
.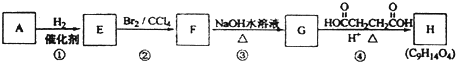
 .
. .
. .C的一氯代物只有一种(不考虑立体异构),则C的结构简式为
.C的一氯代物只有一种(不考虑立体异构),则C的结构简式为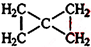 .
.