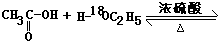题目内容
如图是元素周期表的一部分,有关说法不正确的是( )
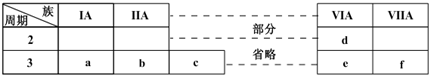

| A、b、d、f四种元素的原子半径:b>f>d |
| B、元素b的单质不能与酸性氧化物发生化学反应 |
| C、元素c的氧化物既能与酸反应,又能与碱反应 |
| D、a、c、e的最高价氧化物对应的水化物之间能够相互反应 |
考点:位置结构性质的相互关系应用,元素周期表的结构及其应用
专题:元素周期律与元素周期表专题
分析:由元素的位置可知,a为Na,b为Mg,c为Al,d为F,e为Cl,f为Ar.
A.电子层越多,半径越大;同周期原子序数大的半径小;
B.Mg能与二氧化碳反应;
C.氧化铝为两性氧化物;
D.a、c、e的最高价氧化物对应的水化物分别为NaOH、Al(OH)3、HClO4,分别为碱、两性氢氧化物、酸.
A.电子层越多,半径越大;同周期原子序数大的半径小;
B.Mg能与二氧化碳反应;
C.氧化铝为两性氧化物;
D.a、c、e的最高价氧化物对应的水化物分别为NaOH、Al(OH)3、HClO4,分别为碱、两性氢氧化物、酸.
解答:
解:由元素的位置可知,a为Na,b为Mg,c为Al,d为F,e为Cl,f为Ar.
A.电子层越多,半径越大;同周期原子序数大的半径小,则b、d、f四种元素的原子半径:b>f>d,故A正确;
B.Mg能与二氧化碳反应,二氧化碳为酸性氧化物,故B错误;
C.氧化铝为两性氧化物,既能与酸反应,又能与碱反应,故C正确;
D.a、c、e的最高价氧化物对应的水化物分别为NaOH、Al(OH)3、HClO4,分别为碱、两性氢氧化物、酸,水化物之间能够相互反应,故D正确;
故选B.
A.电子层越多,半径越大;同周期原子序数大的半径小,则b、d、f四种元素的原子半径:b>f>d,故A正确;
B.Mg能与二氧化碳反应,二氧化碳为酸性氧化物,故B错误;
C.氧化铝为两性氧化物,既能与酸反应,又能与碱反应,故C正确;
D.a、c、e的最高价氧化物对应的水化物分别为NaOH、Al(OH)3、HClO4,分别为碱、两性氢氧化物、酸,水化物之间能够相互反应,故D正确;
故选B.
点评:本题考查位置、结构、性质的关系及应用,为高频考点,把握元素的位置及元素化合物性质为解答的关键,选项B为易错点,侧重分析与应用知识能力的考查,题目难度不大.

练习册系列答案
相关题目
用浓度为0.5mol/L的醋酸与锌反应,若先向该醋酸溶液中加入较多的醋酸钠固体,则产生H2的速率将( )
| A、变快 | B、变慢 |
| C、先变快,后变慢 | D、不变 |
下列物质不属于有机物的是( )
| A、乙酸 | B、碳酸钠 | C、乙醇 | D、乙烯 |
在Al与稀H2SO4的反应中,已知10s末H2SO4的浓度减少了0.6mol?L-1,若不考虑反应过程中溶液体积的变化,则10s内生成Al2(SO4)3的平均反应速率为( )
| A、0.02 mol?L-1?s-1 |
| B、0.04 mol?L-1?s-1 |
| C、0.06 mol?L-1?s-1 |
| D、0.18 mol?L-1?s-1 |
下列说法正确的是( )
| A、非金属元素(稀有气体元素除外)都是主族元素,单质在反应中都只能作氧化剂 |
| B、常温下,1mol氯气和足量稀NaOH溶液完全反应转移1mol电子 |
| C、在加热条件下,用乙醇除去乙酸乙酯中的乙酸 |
| D、硫酸铜溶液显酸性的原因:Cu2++2H2O═Cu(OH)2↓+2H+ |
下列说法正确的是( )
| A、原子的半径越小,其原子序数越大 |
| B、最外层电子数少的原子一定比最外层电子数多的原子易失电子 |
| C、金属性、非金属性强弱从根本上取决于其原子核外电子的排布情况 |
| D、元素的化合价越高,其金属性越强 |
常温下,将20mL 0.1mol?L-1 NaOH溶液与V mL 0.1mol?L-1 HX溶液发生中和反应,得到混合溶液pH=a.下列有关说法正确的是( )
| A、若a>7,则一定有V<20 |
| B、若a=7,则一定有c(Na+)=c(X-) |
| C、若V<20,则一定有c(Na+)>c(X-)>c(OH-)>c(H+) |
| D、若V=20,则一定有c(Na+)+c(H+)=c(HX)+c(X-)+c(OH+) |
将60g由甲烷和乙烯组成的混合气体通入盛有足量溴水的容器里,盛溴水的容器的总质量增加28g,则原混合气中甲烷和乙烯的物质的量之比为( )
| A、1:2 | B、2:1 |
| C、3:2 | D、2:3 |