题目内容
在Al与稀H2SO4的反应中,已知10s末H2SO4的浓度减少了0.6mol?L-1,若不考虑反应过程中溶液体积的变化,则10s内生成Al2(SO4)3的平均反应速率为( )
| A、0.02 mol?L-1?s-1 |
| B、0.04 mol?L-1?s-1 |
| C、0.06 mol?L-1?s-1 |
| D、0.18 mol?L-1?s-1 |
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:根据v=
计算10s内硫酸的反应速率v(H2SO4),发生反应方程式为:2Al+3H2SO4=Al2(SO4)3+3H2↑,利用反应速率之比等于化学计量数之比进行计算出v[Al2(SO4)3].
| △c |
| △t |
解答:
解:10s末硫酸的浓度减少了0.6mol?L-1,则v(H2SO4)=
=0.06mol/(L.s),
发生反应方程式为:2Al+3H2SO4=Al2(SO4)3+3H2↑,
反应速率之比等于化学计量数之比,则v[Al2(SO4)3]=
.v(H2SO4)=
×0.06mol/(L.s)=0.02mol/(L.s),
故选A.
| 0.6mol/L |
| 10s |
发生反应方程式为:2Al+3H2SO4=Al2(SO4)3+3H2↑,
反应速率之比等于化学计量数之比,则v[Al2(SO4)3]=
| 1 |
| 3 |
| 1 |
| 3 |
故选A.
点评:本题考查了化学反应速率与化学计量数的关系,题目难度不大,注意明确化学反应速率的概念及计算方法,明确化学反应速率与化学计量数成正比.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列变化是物理变化的是( )
| A、将金属钠和金属钾混合研磨得到液体 |
| B、刚切开的金属钠放置在空气中变暗 |
| C、刚切开的金属钠放置在空气中加热变成淡黄色 |
| D、一小块钠投入到水中熔成闪亮的小球 |
鉴别稀硫酸和浓硫酸最简单的方法是( )
| A、加酚酞试液 |
| B、与铜片反应 |
| C、加BaCl2溶液和硝酸 |
| D、用玻璃棒各蘸一点滴在纸上 |
以下说法正确的是( )
| A、同温同压下,相同体积的任何物质,物质的量也相同 |
| B、0.5mol氢的质量是0.5g |
| C、0.1mol H2SO4含有氢原子数的精确值为1.204×1023 |
| D、同质量的H2和Cl2相比,H2所含的分子数多 |
如图是元素周期表的一部分,有关说法不正确的是( )
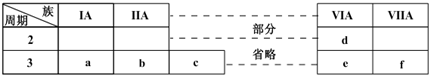

| A、b、d、f四种元素的原子半径:b>f>d |
| B、元素b的单质不能与酸性氧化物发生化学反应 |
| C、元素c的氧化物既能与酸反应,又能与碱反应 |
| D、a、c、e的最高价氧化物对应的水化物之间能够相互反应 |
下列叙述正确的是( )
| A、Fe分别与氯气和稀盐酸反应所得氯化物相同 |
| B、某无色溶液中通入Cl2,溶液变为淡黄色,再加入淀粉溶液,溶液变为蓝色,说明原溶液中存在I- |
| C、CO2、NO2、SO2都能与H2O反应,其反应原理相同 |
| D、C、N、S三种单质直接与02反应都能生成两种氧化物 |
化学与社会生活密切相关,下列说法正确的是( )
| A、粘胶纤维、铜氨纤维、涤纶、光导纤维都是有机高分子材料 |
| B、N7H9禽流感病毒并不可怕,人只要喝一定量盐水,就能杀死该病毒 |
| C、有一种新发现的固态碳,称为“纳米泡沫”,外形似海绵,密度小、有磁性,它与金刚石都属于碳的同素异形体 |
| D、分子间作用力比化学键弱得多,它对物质的熔点、沸点有较大影响,但对溶解度无影响 |
下列说法正确的是( )
| A、0.1mol/L NaHCO3溶液中:c(HCO3-)+c(CO32-)+c(OH-)>c(Na+)+c(H+)+c(H2CO3) |
| B、常温下,5mL 0.02mol/L HCl溶液与5mL 0.02mol/L Ba(OH)2溶液混合,经充分反应后,如果溶液体积为10mL,则溶液pH=12 |
| C、相同条件下pH=5的①NH4Cl溶液 ②CH3COOH溶液 ③稀盐酸,三种溶液中由水电离产生的c(H+):①>②>③ |
| D、常温下,将稀NaOH溶液与CH3COOH溶液混合,可能出现pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)的情况 |