题目内容
乙酸化学性质:
(1)酸的通性:电离方程式:
①使石蕊变 ②活泼金属生成氢气
③与氢氧化钠溶液中和的离子方程式:
④与氧化铜反应的离子方程式:
⑤与碳酸钠反应的离子方程式:
酸性:CH3COOH H2CO3
(2)酯化反应
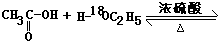 反应类型 或 .
反应类型 或 .
①酸去 醇去 ②为可逆反应,浓硫酸作用 ③碎瓷片的作用
④加入试剂顺序 → → ⑤饱和碳酸钠溶液的作用
⑥反应现象:饱和碳酸钠溶液的上方有一层 有 的香味.
(1)酸的通性:电离方程式:
①使石蕊变
③与氢氧化钠溶液中和的离子方程式:
④与氧化铜反应的离子方程式:
⑤与碳酸钠反应的离子方程式:
酸性:CH3COOH
(2)酯化反应
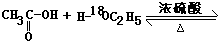
①酸去
④加入试剂顺序
⑥反应现象:饱和碳酸钠溶液的上方有一层
考点:乙酸的化学性质
专题:有机物的化学性质及推断
分析:(1)乙酸具有酸通性,能电离产生氢离子;溶液显酸性,能够使指示剂变色、与活泼金属反应生成氢气;能与酸发生酸碱中和反应;能与碱性氧化物反应生成盐;能与盐反应生成新的酸和盐;
(2)乙酸与乙醇在浓硫酸做催化剂、吸水剂的条件下,发生酯化反应,生成乙酸乙酯和水;
①依据酯化反应的原理解答;
②依据浓硫酸性质分析其在反应中的作用;
③该反应非常剧烈,容易发生暴沸;
④依据浓硫酸稀释放热,乙醇、乙酸易挥发的性质解答;
⑤依据乙醇能溶于水,乙酸能与碳酸钠反应,乙酸乙酯不溶于水解答;
⑥依据乙酸乙酯的密度小于水,具有香味的性质解答.
(2)乙酸与乙醇在浓硫酸做催化剂、吸水剂的条件下,发生酯化反应,生成乙酸乙酯和水;
①依据酯化反应的原理解答;
②依据浓硫酸性质分析其在反应中的作用;
③该反应非常剧烈,容易发生暴沸;
④依据浓硫酸稀释放热,乙醇、乙酸易挥发的性质解答;
⑤依据乙醇能溶于水,乙酸能与碳酸钠反应,乙酸乙酯不溶于水解答;
⑥依据乙酸乙酯的密度小于水,具有香味的性质解答.
解答:
解:(1)乙酸为弱电解质,电离方程式为:CH3COOH CH3COO-+H+,
故答案为:CH3COOH?CH3COO-+H+;
(2)①乙酸溶于水,电离产生氢离子,溶液显酸性,能够使石蕊变红;
故答案为:红;
②乙酸具有酸性,能够与活泼金属反应生成氢气;
故答案为:能;
③与氢氧化钠溶液中和的离子方程式:CH3COOH+OH-=CH3COO-+H2O,
故答案为:CH3COOH+OH-=CH3COO-+H2O;
④与氧化铜反应的离子方程式:2CH3COOH+CuO=Cu2++2CH3COO-+H2O,
故答案为:2CH3COOH+CuO=Cu2++2CH3COO-+H2O;
⑤与碳酸钠反应的离子方程式:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑,
故答案为:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑;
⑥依据强酸制弱酸的规律可知,醋酸的酸性大于碳酸;
故答案为:>;
(2)醋酸与乙醇发生酯化反应的方程式为: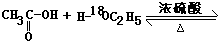 CH3CO18OC2H5+H2O,
CH3CO18OC2H5+H2O,
故答案为: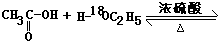 CH3CO18OC2H5+H2O,酯化 取代;
CH3CO18OC2H5+H2O,酯化 取代;
①酯化反应的原理是:酸去羟基,醇去氢;
故答案为:羟基 氢;
②浓硫酸具有吸水性,在酯化反应中起:催化剂和吸水剂的作用;
故答案为:催化剂 吸水剂;
③该反应非常剧烈,容易发生暴沸,加入碎瓷片可以防止暴沸;
故答案为:防止暴沸;
④乙酸与乙醇发生酯化反应是可逆的,浓硫酸稀释产生大量的热,乙酸和乙醇易挥发,为提高乙酸的转化率,所以顺序应该是先加乙醇,再加浓硫酸,再加乙酸;
故答案为:乙醇 浓硫酸 乙酸;
⑤乙酸乙酯是不溶于水的物质,乙醇和乙酸均是易溶于水的,乙酸和乙醇的碳酸钠水溶液是互溶的,所以饱和碳酸钠溶液的作用是除去乙酸乙酯中的乙酸和乙醇,降低乙酸乙酯的溶解度,便于分层,
故答案为:除去乙酸乙酯中的乙酸和乙醇,降低乙酸乙酯的溶解度,便于分层;
⑥乙酸乙酯的密度小于水,具有水果香味,
故答案为:透明的油状液体;水果.
故答案为:CH3COOH?CH3COO-+H+;
(2)①乙酸溶于水,电离产生氢离子,溶液显酸性,能够使石蕊变红;
故答案为:红;
②乙酸具有酸性,能够与活泼金属反应生成氢气;
故答案为:能;
③与氢氧化钠溶液中和的离子方程式:CH3COOH+OH-=CH3COO-+H2O,
故答案为:CH3COOH+OH-=CH3COO-+H2O;
④与氧化铜反应的离子方程式:2CH3COOH+CuO=Cu2++2CH3COO-+H2O,
故答案为:2CH3COOH+CuO=Cu2++2CH3COO-+H2O;
⑤与碳酸钠反应的离子方程式:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑,
故答案为:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑;
⑥依据强酸制弱酸的规律可知,醋酸的酸性大于碳酸;
故答案为:>;
(2)醋酸与乙醇发生酯化反应的方程式为:
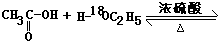 CH3CO18OC2H5+H2O,
CH3CO18OC2H5+H2O,故答案为:
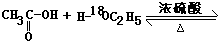 CH3CO18OC2H5+H2O,酯化 取代;
CH3CO18OC2H5+H2O,酯化 取代;①酯化反应的原理是:酸去羟基,醇去氢;
故答案为:羟基 氢;
②浓硫酸具有吸水性,在酯化反应中起:催化剂和吸水剂的作用;
故答案为:催化剂 吸水剂;
③该反应非常剧烈,容易发生暴沸,加入碎瓷片可以防止暴沸;
故答案为:防止暴沸;
④乙酸与乙醇发生酯化反应是可逆的,浓硫酸稀释产生大量的热,乙酸和乙醇易挥发,为提高乙酸的转化率,所以顺序应该是先加乙醇,再加浓硫酸,再加乙酸;
故答案为:乙醇 浓硫酸 乙酸;
⑤乙酸乙酯是不溶于水的物质,乙醇和乙酸均是易溶于水的,乙酸和乙醇的碳酸钠水溶液是互溶的,所以饱和碳酸钠溶液的作用是除去乙酸乙酯中的乙酸和乙醇,降低乙酸乙酯的溶解度,便于分层,
故答案为:除去乙酸乙酯中的乙酸和乙醇,降低乙酸乙酯的溶解度,便于分层;
⑥乙酸乙酯的密度小于水,具有水果香味,
故答案为:透明的油状液体;水果.
点评:本题考查了乙酸的性质,和乙酸乙酯的制备试验,题目难度不大,侧重考查课本基础知识,注意对基础知识的巩固.

练习册系列答案
相关题目
能够鉴别醋酸溶液、葡萄糖溶液、蔗糖溶液的试剂是( )
| A、稀盐酸 |
| B、Cu(OH)2悬浊液 |
| C、NaOH溶液 |
| D、Na2CO3溶液 |
某元素气态氢化物化学式为RH4,此元素最高价氧化物对应水化物的化学式可能是( )
| A、H2RO3 |
| B、H2RO4 |
| C、HRO3 |
| D、H3RO4 |
如图是元素周期表的一部分,有关说法不正确的是( )
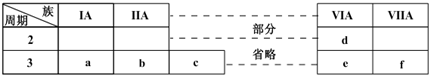

| A、b、d、f四种元素的原子半径:b>f>d |
| B、元素b的单质不能与酸性氧化物发生化学反应 |
| C、元素c的氧化物既能与酸反应,又能与碱反应 |
| D、a、c、e的最高价氧化物对应的水化物之间能够相互反应 |