题目内容
用浓度为0.5mol/L的醋酸与锌反应,若先向该醋酸溶液中加入较多的醋酸钠固体,则产生H2的速率将( )
| A、变快 | B、变慢 |
| C、先变快,后变慢 | D、不变 |
考点:化学反应速率的影响因素,弱电解质在水溶液中的电离平衡
专题:化学反应速率专题
分析:加入较多的醋酸钠会电离出醋酸根离子,从而使的电离平衡逆向移动,氢离降低,所以速率应该变慢.
解答:
解:加入较多的醋酸钠会电离出醋酸根离子,从而使的电离平衡逆向移动,氢离降低,所以速率应该变慢,故选B.
点评:本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某元素气态氢化物化学式为RH4,此元素最高价氧化物对应水化物的化学式可能是( )
| A、H2RO3 |
| B、H2RO4 |
| C、HRO3 |
| D、H3RO4 |
下列变化是物理变化的是( )
| A、将金属钠和金属钾混合研磨得到液体 |
| B、刚切开的金属钠放置在空气中变暗 |
| C、刚切开的金属钠放置在空气中加热变成淡黄色 |
| D、一小块钠投入到水中熔成闪亮的小球 |
下列各组微粒半径之比大于1的是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
鉴别稀硫酸和浓硫酸最简单的方法是( )
| A、加酚酞试液 |
| B、与铜片反应 |
| C、加BaCl2溶液和硝酸 |
| D、用玻璃棒各蘸一点滴在纸上 |
如图是元素周期表的一部分,有关说法不正确的是( )
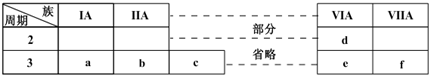

| A、b、d、f四种元素的原子半径:b>f>d |
| B、元素b的单质不能与酸性氧化物发生化学反应 |
| C、元素c的氧化物既能与酸反应,又能与碱反应 |
| D、a、c、e的最高价氧化物对应的水化物之间能够相互反应 |
下列实验能达到目的是( )
| A、用浓HNO3与Cu反应制备NO2 |
| B、用BaCl2溶液鉴别CO2与SO2 |
| C、用溴水鉴别苯和正已烷 |
| D、将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl |