题目内容
常温下,将20mL 0.1mol?L-1 NaOH溶液与V mL 0.1mol?L-1 HX溶液发生中和反应,得到混合溶液pH=a.下列有关说法正确的是( )
| A、若a>7,则一定有V<20 |
| B、若a=7,则一定有c(Na+)=c(X-) |
| C、若V<20,则一定有c(Na+)>c(X-)>c(OH-)>c(H+) |
| D、若V=20,则一定有c(Na+)+c(H+)=c(HX)+c(X-)+c(OH+) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.pH=a>7,溶液显示碱性,当V=20mL时,氢氧化钠与HA恰好反应生成NaX,如果HA为弱电解质,则NaX为强碱弱酸盐,溶液显示碱性;
B.若a=7,溶液中一定满足c(H+)=c(OH-),根据电荷守恒可知,c(Na+)=c(X-);
C.若V<20,当HX体积很小时,则可能出现c(OH-)>c(X-);不一定存在c(X-)>c(OH-)的关系;
D.溶液中一定遵循电荷守恒,c(Na+)+c(H+)=c(X-)+c(OH+),根据电荷守恒进行判断.
B.若a=7,溶液中一定满足c(H+)=c(OH-),根据电荷守恒可知,c(Na+)=c(X-);
C.若V<20,当HX体积很小时,则可能出现c(OH-)>c(X-);不一定存在c(X-)>c(OH-)的关系;
D.溶液中一定遵循电荷守恒,c(Na+)+c(H+)=c(X-)+c(OH+),根据电荷守恒进行判断.
解答:
解:A.当pH=a>7,溶液显示碱性,若氢氧化钠溶液V=20mL时,氢氧化钠与HX的物质的量相等,氢氧化钠与HA恰好反应生成NaX,若HA为弱电解质,则NaX为强碱弱酸盐,溶液显示碱性,所以V不一定小于20,故A错误;
B.如果混合液的pH=a=7,溶液显示中性,则c(H+)=c(OH-),根据电荷守恒(X-)+c(H+)=c(OH-)+c(Na+)可知:c(Na+)=c(X-),故B正确;
C.若V<20,如果HA 的体积比较小时,混合液中可能存在:c(OH-)>c(X-),溶液中离子浓度关系为:c(Na+)>c(OH-)>c(X-)>c(H+),故C错误;
D.任何溶液中一定遵循电荷守恒:c(Na+)+c(H+)=c(X-)+c(OH+),则V=20时,如果HA为弱电解质,则一定有c(Na+)+c(H+)<c(HX)+c(X-)+c(OH+),故D错误;
故选B.
B.如果混合液的pH=a=7,溶液显示中性,则c(H+)=c(OH-),根据电荷守恒(X-)+c(H+)=c(OH-)+c(Na+)可知:c(Na+)=c(X-),故B正确;
C.若V<20,如果HA 的体积比较小时,混合液中可能存在:c(OH-)>c(X-),溶液中离子浓度关系为:c(Na+)>c(OH-)>c(X-)>c(H+),故C错误;
D.任何溶液中一定遵循电荷守恒:c(Na+)+c(H+)=c(X-)+c(OH+),则V=20时,如果HA为弱电解质,则一定有c(Na+)+c(H+)<c(HX)+c(X-)+c(OH+),故D错误;
故选B.
点评:本题考查了酸碱混合的定性判断、溶液中离子浓度大小比较,题目难度中等,注意掌握溶液酸碱性与溶液pH的计算方法,能够根据电荷守恒、物料守恒、盐的水解原理判断溶液中离子浓度大小.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
某元素气态氢化物化学式为RH4,此元素最高价氧化物对应水化物的化学式可能是( )
| A、H2RO3 |
| B、H2RO4 |
| C、HRO3 |
| D、H3RO4 |
如图是元素周期表的一部分,有关说法不正确的是( )
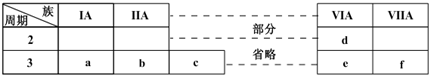

| A、b、d、f四种元素的原子半径:b>f>d |
| B、元素b的单质不能与酸性氧化物发生化学反应 |
| C、元素c的氧化物既能与酸反应,又能与碱反应 |
| D、a、c、e的最高价氧化物对应的水化物之间能够相互反应 |
(双项)下列说法正确的是( )
| A、氢键是一种化学键 |
| B、氢键使物质具有较高的熔、沸点 |
| C、能与水分子形成氢键的物质易溶于水 |
| D、水结成冰体积膨胀与氢键无关 |
化学与社会生活密切相关,下列说法正确的是( )
| A、粘胶纤维、铜氨纤维、涤纶、光导纤维都是有机高分子材料 |
| B、N7H9禽流感病毒并不可怕,人只要喝一定量盐水,就能杀死该病毒 |
| C、有一种新发现的固态碳,称为“纳米泡沫”,外形似海绵,密度小、有磁性,它与金刚石都属于碳的同素异形体 |
| D、分子间作用力比化学键弱得多,它对物质的熔点、沸点有较大影响,但对溶解度无影响 |
下列实验能达到目的是( )
| A、用浓HNO3与Cu反应制备NO2 |
| B、用BaCl2溶液鉴别CO2与SO2 |
| C、用溴水鉴别苯和正已烷 |
| D、将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl |
下列关于碳酸钠和碳酸氢钠的比较中,正确的是( )
| A、二者在水中的溶解度不同,碳酸氢钠的溶解度大于碳酸钠的溶解度 |
| B、二者热稳定性不同,碳酸钠的热稳定性大于碳酸氢钠的热稳定性 |
| C、二者都能与盐酸反应放出二氧化碳气体,但产气量和反应快慢不同 |
| D、二者在一定的条件下可以相互转化 |