题目内容
17.室温时,HA溶液和HB溶液分别加水稀释,溶液的pH变化如图所示.下列说法不正确的是( )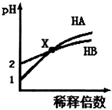
| A. | HB一定是弱酸 | |
| B. | 在x点,c(A-)=c(B-) | |
| C. | 稀释前由水电离出的c(H+),HB溶液是HA溶液的10倍 | |
| D. | 取x点时的两种酸溶液,分别中和等体积等浓度的NaOH溶液,消耗HA溶液的体积一定小于HB溶液的体积 |
分析 由图可知,加水稀释时HA的pH变化比HB大,说明HB为弱酸,HA的酸性比HB强,X点时,氢离子浓度相同,据此分析.
解答 解:A、加水稀释时HA的pH变化比HB大,说明HB为弱酸,故A正确;
B、X点时,氢离子浓度相同,据电荷守恒c(A-)=c(B-),故B正确;
C、加水稀释前,HA的pH=1,由水电离出来的氢离子浓度为10-13mol/L,HB的pH=2,由水电离出来的氢离子浓度为10-12mol/L,所以由水电离出的c(H+),HB溶液是HA溶液的10倍,根C正确;
D、HA的酸性比HB强,X点时,氢离子浓度相同,HB的物质的量大于HA,所以分别中和等体积等浓度的NaOH溶液,消耗HA溶液的体积一定大于HB溶液的体积,故D错误;
故选D.
点评 本题考查电解质在水中的电离及图象,侧重于学生的分析能力的考查,明确图象中pH的变化及交点的意义是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
8.FeCO3与砂糖混用可以作补血剂,实验室里制备FeCO3的流程如图所示.下列说法错误的是( )
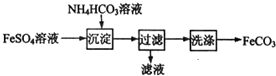

| A. | 可利用KSCN溶液检验FeSO4溶液是否变质 | |
| B. | 沉淀过程中有CO2气体放出 | |
| C. | 过滤搡作的常用玻璃仪器有烧杯、漏斗和玻璃棒 | |
| D. | 产品FeCO3在空气中高温分解可得到纯净的FeO |
5.某强酸性溶液X中含有NH4+、A13+、Ba2+、Fe2+、CO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行如下实验:下列有关推断合理的是( )


| A. | 溶液中一定没有Ba2+、NO3-、CO32- | |
| B. | 溶液中一定含有H+、NH4+、Fe2+、SO42-、Cl- | |
| C. | 沉淀H为一定Al(OH)3和BaCO3的混合物 | |
| D. | 若溶液X的体积为100 mL,产生标况下112 mL气体A,则X中c(Fe2+)=0.05mol•L-1 |
12.为测定碱式碳酸钴[COx(OH)y(CO3)z]的化学组成,研究性学习小组的同学设计了如图所示的装置进行实验探究.已知:碱式碳酸钴受热时可分解生成三种氧化物.
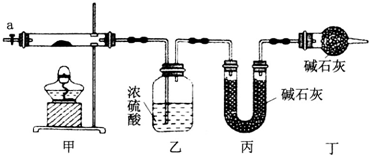
(1)按如图所示装置组装好仪器,并检查装置气密性;称取3.65g样品置于硬质玻璃管内,加热,当乙装置中不再有气泡产生时(填实验现象),停止加热;打开活塞a,缓缓通入空气数分钟,通入空气的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中.
(2)某同学认为上述实验中存在一个缺陷,该缺陷是未考虑空气中的水蒸气和二氧化碳对实验的影响.
(3)通过正确实验测得乙、丙装置增重分别为0.36g、0.88g,则该碱式碳酸钴的化学式为Co3(OH)4(CO3)2.
(4)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取COCl2•6H2O的一种工艺如下:
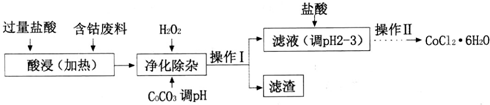
已知;25℃时
①净化除杂时,加入H2O2发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为Fe(OH)3和Al(OH)3;
③加盐酸调整pH为2~3的目的为抑制CoCl2的水解;
④操作Ⅱ过程为蒸发浓缩、冷却结晶、过滤.

(1)按如图所示装置组装好仪器,并检查装置气密性;称取3.65g样品置于硬质玻璃管内,加热,当乙装置中不再有气泡产生时(填实验现象),停止加热;打开活塞a,缓缓通入空气数分钟,通入空气的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中.
(2)某同学认为上述实验中存在一个缺陷,该缺陷是未考虑空气中的水蒸气和二氧化碳对实验的影响.
(3)通过正确实验测得乙、丙装置增重分别为0.36g、0.88g,则该碱式碳酸钴的化学式为Co3(OH)4(CO3)2.
(4)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取COCl2•6H2O的一种工艺如下:

已知;25℃时
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为Fe(OH)3和Al(OH)3;
③加盐酸调整pH为2~3的目的为抑制CoCl2的水解;
④操作Ⅱ过程为蒸发浓缩、冷却结晶、过滤.
2.饱和一元醇R(C5H12O)以银为催化剂进行催化氧化得醛M,再经过酸性KMnO4氧化最终得到羧酸N,则R与N最多可形成酯( )
| A. | 9种 | B. | 16种 | C. | 32种 | D. | 64种 |
9.化学在生产和日常生活中有着重要的应用.下列说法错误的是( )
| A. | 苯、乙醇和乙酸都能发生取代反应 | |
| B. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 | |
| C. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 | |
| D. | 白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去 |
6.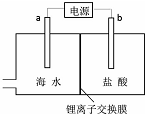 海水中含有丰富的锂资源,研究人员开发了一种只能让锂离子通过的特殊交换膜,并运用电解实现从海水中提取高浓度的锂盐,其工作原理如图所示?下列说法不正确的是( )
海水中含有丰富的锂资源,研究人员开发了一种只能让锂离子通过的特殊交换膜,并运用电解实现从海水中提取高浓度的锂盐,其工作原理如图所示?下列说法不正确的是( )
 海水中含有丰富的锂资源,研究人员开发了一种只能让锂离子通过的特殊交换膜,并运用电解实现从海水中提取高浓度的锂盐,其工作原理如图所示?下列说法不正确的是( )
海水中含有丰富的锂资源,研究人员开发了一种只能让锂离子通过的特殊交换膜,并运用电解实现从海水中提取高浓度的锂盐,其工作原理如图所示?下列说法不正确的是( )| A. | a连接电源的正极 | |
| B. | Li+的移动方向是从海水进入到盐酸中 | |
| C. | 一段时间后,b电极附近溶液的pH降低 | |
| D. | 电解过程中还可能获得有经济价值的副产物氢气和氯气 |
7.其他条件不变,升高温度下列数据一定增大的是( )
| A. | 碱在水中的溶解度 | B. | 乙酸溶液的pH | ||
| C. | 合成氨的反应热 | D. | 醋酸钠溶液中的氢氧根离子浓度 |
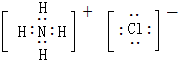 ,Y的最简单氢化物分子呈三角锥型;
,Y的最简单氢化物分子呈三角锥型;