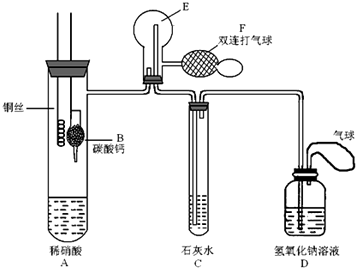
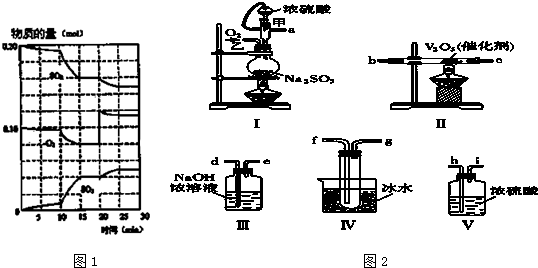
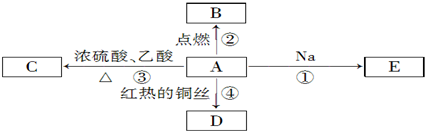
题目内容
10.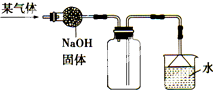 如图是收集某气体的装置.由实验装置推测该气体的有关性质可能正确的是( )
如图是收集某气体的装置.由实验装置推测该气体的有关性质可能正确的是( )| 选项 | A | B | C | D |
| 密度比空气 | 大 | 大 | 小 | 小 |
| 溶于水中所得溶液的pH | >7 | <7 | >7 | <7 |
| 在水中的溶解性 | 大 | 小 | 大 | 小 |
| A. | A | B. | B | C. | C | D. | D |
分析 排空气收集气体时,密度大于空气的气体采取向上排气法收集,密度小于空气则向下排气法收集;可以用氢氧化钠干燥的气体应该是碱性气体.
解答 解:题图中的收集气体方法:气体从位于集气瓶口的导管进入,瓶中的空气则是从位于瓶底部的导管被排出,这种收集气体的方法也就属于向下排气法,说明该气体密度小于空气;此气体可以用氢氧化钠干燥,所以应该是碱性气体,溶于水中所得溶液的pH应该大于7,可用水吸收尾气,说明气体易溶于水.
故选C.
点评 本题考查气体的收集,难度不大,排气法收集气体时,导管要伸到集气瓶底部,就是为了把瓶内空气全部排出.

练习册系列答案
相关题目
1.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 水电离的c(H+)=1×10-12mol•L-1的溶液中:K+、Na+、AlO2-、Cl- | |
| B. | 使石蕊变红色的溶液中:Na+、Al3+、SO42-、CO32- | |
| C. | Kw/C(H+)=1×10-13mol•L-1的溶液中:NH4+、Fe3+、Cl-、NO3- | |
| D. | 与Al反应能放出H2的溶液中:Na+、K+、NO3-、SO42- |
18.已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
Fe3+→Fe2+ MnO4-→Mn2+ Cr2O72-→Cr3+ HNO3→NO
如果分别用上述这些物质氧化KI得到等量的I2,消耗物质的量最少的物质是( )
Fe3+→Fe2+ MnO4-→Mn2+ Cr2O72-→Cr3+ HNO3→NO
如果分别用上述这些物质氧化KI得到等量的I2,消耗物质的量最少的物质是( )
| A. | Fe3+ | B. | MnO4- | C. | Cr2O72- | D. | HNO3 |
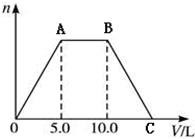 向NaOH和Ca(OH)2的混合溶液中不断地通入足量的CO2气体,生成的沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图,试回答:
向NaOH和Ca(OH)2的混合溶液中不断地通入足量的CO2气体,生成的沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图,试回答: ,用单线桥法分析上述反应.
,用单线桥法分析上述反应.