题目内容
18.常温下,对物质的量浓度均为0.1mol•L-1的①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液各25mL,下列说法错误的是( )| A. | 溶液的pH大小顺序是③>①>② | |
| B. | 分别向其中逐滴滴入相同浓度的盐酸至中性,消耗盐酸最少的是② | |
| C. | 分别稀释相同倍数后,pH变化最大的是② | |
| D. | 分别加入25mL 0.1 mol•L-1盐酸后,pH最大的是① |
分析 A.等浓度时强碱的pH最大;强碱弱酸盐中对应的酸酸性越强,水解程度越小,酸性越强,pH越小;
B.碱性越强消耗的盐酸越多;
C.稀释时强碱的变化程度大;
D、根据酸碱混合后溶液中的溶质来分析.
解答 解:A.等浓度时强碱的pH最大,强碱弱酸盐中对应的酸性越强,水解程度越小,碳酸氢根离子的酸性小于醋酸,所以3种溶液pH的大小顺序是③>①>②,故A正确;
B.分别向其中逐滴滴入相同浓度的盐酸至中性,碱性强的消耗的盐酸多,所以消耗盐酸最少的是CH3COONa溶液,故B正确;
C.稀释时强碱的变化程度大,所以三种溶液稀释相同倍数,pH变化最大的是③,故C错误;
D.等体积等浓度混合后,按照1:1和氯化氢反应,①中溶质为NaHCO3、NaCl,②中溶质为NaCl、CH3COOH,③中溶质为NaCl;HCO3-离子水解显碱性,所以pH最大的是①,故D正确;
故选:C.
点评 本题考查盐类水解、pH的判断等,明确酸碱混合的计算,盐类水解的规律、pH与浓度的关系等知识即可解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.一定量的氢气在一定条件下完全燃烧生成气态水,放出热量值为Q1,等量的氢气在同样条件下完全燃烧生成液态水,放出热量值为Q2,Q1与Q2的关系为( )
| A. | Q1>Q2 | B. | Q1=Q2 | C. | Q1<Q2 | D. | 无法确定 |
6.下列实验装置图及实验用品均正确的是(部分夹持仪器未画出)( )
| A. | 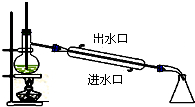 石油的蒸馏 | B. | 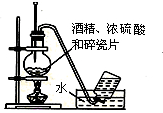 实验室用乙醇制乙烯 | ||
| C. | 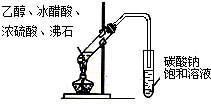 实验室制取乙酸乙酯 | D. | 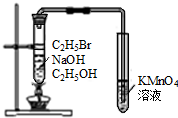 验证溴乙烷发生消去反应 |
13.某碳、氢、氧有机物的蒸气密度是CO2的2倍(相同条件),它含有“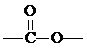 ”的同分异构体有( )
”的同分异构体有( )
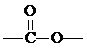 ”的同分异构体有( )
”的同分异构体有( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 8种 |
3.有机物数量庞大,下列有关它们的说法中正确的是( )
| A. | 可用新制备的Cu(OH)2悬浊液将乙醇、乙酸、葡萄糖、蔗糖几种溶液区别开 | |
| B. | 乙烯与HCl、乙烷与Cl2这两组反应均可得到CH3CH2Cl,但二者反应类型不同 | |
| C. | 分子中有三个甲基且分子式C6H14的烃最多有三种 | |
| D. | 苯能发生加成反应、取代反应但不能发生氧化反应 |
7.下列说法正确的是( )
| A. | 某晶体固态不导电,水溶液能导电说明该晶体是离子晶体 | |
| B. | 原子晶体的原子间只存在共价键,而分子晶体内只存在范德华力 | |
| C. | 分子组成相差一个或几个CH2原子团的有机物是同系物 | |
| D. | 在氢原子的基态电子的概率分布图中,小黑点的疏密程度表示电子在该区域空间出现概率的大小 |
8.碳酸钠中含有少量硫酸钠,下列是测定样品纯度的方案:
方案一 样品$\stackrel{CaCl_{2}}{→}$过滤$\stackrel{洗涤、干燥}{→}$称量
方案二 样品$\stackrel{BaCl_{2}}{→}$过滤$\stackrel{洗涤、干燥}{→}$称量
下列叙述正确的是( )
方案一 样品$\stackrel{CaCl_{2}}{→}$过滤$\stackrel{洗涤、干燥}{→}$称量
方案二 样品$\stackrel{BaCl_{2}}{→}$过滤$\stackrel{洗涤、干燥}{→}$称量
下列叙述正确的是( )
| A. | 方案一优于方案二,因为CaCl2比BaCl2更便宜 | |
| B. | 方案一优于方案二,因为其沉淀物溶解度更小沉淀更安全 | |
| C. | 用乙醇洗涤沉淀比用水洗涤,测量结果更准确 | |
| D. | 以上两种方案都必须采集样品的质量、沉淀剂和沉淀物的质量 |
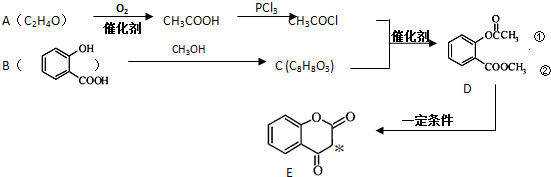
 .
.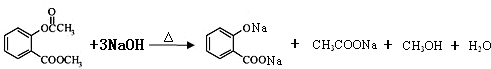 .
.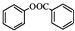 ),根据题目信息设计合成线路,请写出最后一步反应的化学方程式:
),根据题目信息设计合成线路,请写出最后一步反应的化学方程式: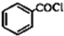 +
+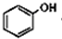 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$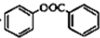 +HCl.
+HCl.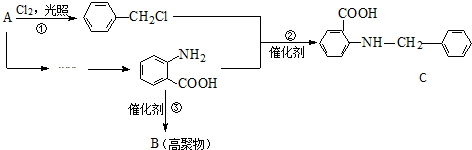
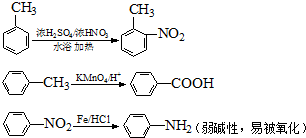
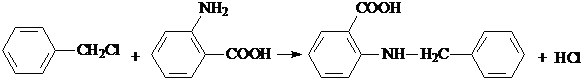 .
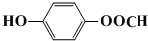
.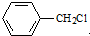 水解产物的同分异构体,且遇氯化铁溶液发生显色反应,写出X所有的可能结构简式:
水解产物的同分异构体,且遇氯化铁溶液发生显色反应,写出X所有的可能结构简式: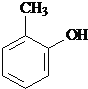 、
、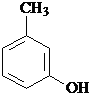 、
、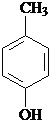 .
.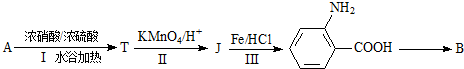
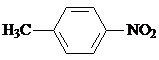 .
.