题目内容
1.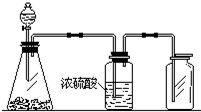 如图是一套实验室制气装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
如图是一套实验室制气装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )| A. | 碳酸钙和稀盐酸 | B. | 二氧化锰和浓盐酸 | ||
| C. | 锌粒和稀硫酸 | D. | 碱石灰和浓氨水 |
分析 该装置的反应装置是固液混合不加热型装置,生成的气体和浓硫酸不反应,所以能用浓硫酸干燥,生成的气体和氧气在常温下不反应,且密度大于空气,所以可以采用向上排空气法收集,据此分析解答.
解答 解:该装置的反应装置是固液混合不加热型装置,生成的气体和浓硫酸不反应,所以能用浓硫酸干燥,生成的气体和氧气在常温下不反应,且密度大于空气,所以可以采用向上排空气法收集,
A.碳酸钙和稀盐酸反应生成二氧化碳时,反应物是固液混合物,且不需加热;二氧化碳和氧气、浓硫酸不反应,且二氧化碳密度大于空气,所以符合条件,故A正确;
B.二氧化锰和浓盐酸制取氯气需要加热,故B错误;
C.锌和稀硫酸反应生成氢气,氢气密度小于空气,应该采用向下排空气法收集,故C错误;
D.碱石灰和浓氨水制取氨气,氨气和浓硫酸反应生成硫酸铵,所以不能用浓硫酸干燥,且氨气密度小于空气,应该采用向下排空气法收集,故D错误;
故选A.
点评 本题以气体的制备、收集和干燥为载体考查化学实验方案评价,明确实验原理是解本题关键,知道常见气体的制备方法,熟悉常见制备装置,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.科学家观测到固体催化剂表面“抓取”一氧化碳分子和氧原子配对生成二氧化碳分子的过程.下列关于碳的氧化物的说法正确的是( )
| A. | CO与CO2均为酸性氧化物 | B. | CO是煤气的主要成分之一 | ||
| C. | CO2是弱电解质 | D. | 大量CO2的排放可导致酸雨的形成 |
12.放射性同位素钬${\;}_{67}^{166}$Ho的原子核内的中子数与质子数之差是( )
| A. | 166 | B. | 99 | C. | 67 | D. | 32 |
16.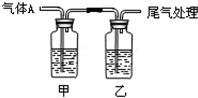 利用如图所示装置进行实验,有关现象和解释均正确的是( )
利用如图所示装置进行实验,有关现象和解释均正确的是( )
 利用如图所示装置进行实验,有关现象和解释均正确的是( )
利用如图所示装置进行实验,有关现象和解释均正确的是( )| 选项 | 足量 气体A | 甲中试剂 | 乙中试剂 | 现象 | 解释 |
| A | CO2 | Na2SiO3 | BaCl2 | 甲浑浊、乙澄清 | 酸性:HCl>H2CO3>H2SiO3 |
| B | Cl2 | 紫色石蕊 | Fe(SCN)2 | 开始均变红 | Cl2溶于水显酸性 |
| C | SO2 | 品红溶液 | KMnO4 | 均褪色 | SO2具有漂白性 |
| D | NH3 | AgNO3 | AlCl3 | 现象相同 | NH3•H2O电离出OH- |
| A. | A | B. | B | C. | C | D. | D |
13.电解NO制备NH4NO3,其工作原理如图所示,下列说法不正确的是( )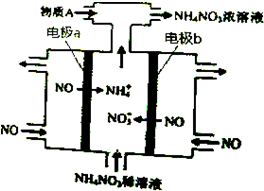

| A. | b极的电极反应为:NO-3e-+2H2O=NO3-+4H+ | |
| B. | 溶液中的H+由电极a处向电极b处迁移 | |
| C. | 电解过程总反应的化学方程式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3 | |
| D. | 为使电解产物全部转化为NH4NO3,需补充的物质A是NH3 |
11.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L二氯甲烷的分子数约为NA个 | |
| B. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol | |
| C. | 17.6 g丙烷中所含的极性共价键为6.4 NA个 | |
| D. | 电解精炼铜时,若阴极得到的电子数为2 NA个,则阳极质量减少64 g |
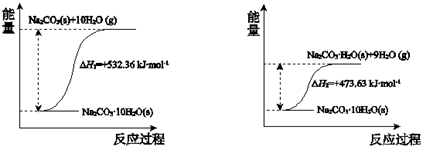


 .
.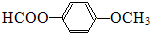 、
、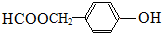 或
或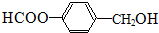 (任写一种).
(任写一种).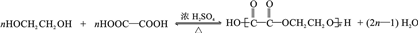 .
.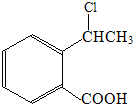 为原料制
为原料制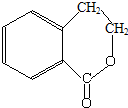 的合成路线流程图(无机试剂任用),在方框中填出相应的物质,并在括号注明反应条件.合成路线流程图示例如图2:
的合成路线流程图(无机试剂任用),在方框中填出相应的物质,并在括号注明反应条件.合成路线流程图示例如图2: