题目内容
16. 利用如图所示装置进行实验,有关现象和解释均正确的是( )
利用如图所示装置进行实验,有关现象和解释均正确的是( )| 选项 | 足量 气体A | 甲中试剂 | 乙中试剂 | 现象 | 解释 |
| A | CO2 | Na2SiO3 | BaCl2 | 甲浑浊、乙澄清 | 酸性:HCl>H2CO3>H2SiO3 |
| B | Cl2 | 紫色石蕊 | Fe(SCN)2 | 开始均变红 | Cl2溶于水显酸性 |
| C | SO2 | 品红溶液 | KMnO4 | 均褪色 | SO2具有漂白性 |
| D | NH3 | AgNO3 | AlCl3 | 现象相同 | NH3•H2O电离出OH- |
| A. | A | B. | B | C. | C | D. | D |
分析 A.碳酸酸性比硅酸强,但比盐酸弱;
B.氯气和水反应生成盐酸和次氯酸,具有强氧化性,可氧化亚铁离子;
C.二氧化硫与高锰酸钾发生氧化还原反应;
D.氨气可与硝酸银发生络合反应.
解答 解:A.碳酸酸性比硅酸强,可生成硅酸沉淀,溶液变浑浊,但比盐酸弱,与氯化钡不反应,可证明酸性强弱,故A正确;
B.氯气和水反应生成盐酸和次氯酸,具有强氧化性,可氧化亚铁离子,表现的性质不同,故B错误;
C.二氧化硫与高锰酸钾发生氧化还原反应,故C错误;
D.氨气可与硝酸银发生络合反应,先生成沉淀后溶解,而氯化铝只生成沉淀,现象不同,故D错误.
故选A.
点评 本题考查较为综合,涉及性质比较以及探究,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握性质的异同以及实验的严密性、可行性的评价,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6. 钠-硫($\frac{Na}{{S}_{8}}$)电池是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过.下列有关说法错误的是( )
钠-硫($\frac{Na}{{S}_{8}}$)电池是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过.下列有关说法错误的是( )
 钠-硫($\frac{Na}{{S}_{8}}$)电池是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过.下列有关说法错误的是( )
钠-硫($\frac{Na}{{S}_{8}}$)电池是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过.下列有关说法错误的是( )| A. | 放电时b为电池的负极 | |
| B. | 充电时阴极反应式为:Na++e-=Na | |
| C. | 充电时,阳极处发生还原反应 | |
| D. | 放电时Na+可以穿过固体电解质流向a电极 |
7.在工农业生产和科学研究中,许多重要的化学反应需要在水溶液中进行,试分析并回答以下问题:
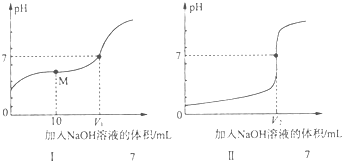
(1)向体积均为20.00mL、浓度均为0.1mol•L-1盐酸和醋酸溶液中分别滴加0.1mol•L-1NaOH溶液.随加入的NaOH溶液体积的增加,溶液pH的变化如图所示:
①用NaOH溶液滴定醋酸溶液的曲线是I(填“I”或“Ⅱ”);
②实验前,上述三种溶液中由水电离出的c(H+)最大的是CH3COOH溶液(填化学式);
③图中V1和V2大小的比较:V1< V2 (填“>”、“<”或“=”);
④图I中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) (用离子的物质的量浓度符号填空).
(2)为了研究沉淀溶解平衡,某同学查阅资料并设计了如下实验(相关数据测定温度及实验环境均为25℃):资料:AgSCN是白色沉淀;Ksp(AgSCN)=1.0×10-12;Ksp(AgI)=8.5×10-17
①步骤2中溶液变红色,说明溶液中存在SCN-,该离子经过步骤1中的反应,在溶液中仍然存在,原因是:由于存在沉淀溶解平衡AgSCN(s)?Ag+(aq)+SCN-(aq),溶液中仍有少量SCN-(用必要的文字和方程式说明);
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为出现白色沉淀;溶液红色变浅(至少答出两条明显现象);
③写出步骤4中沉淀转化反应平衡常数的表达式:K=$\frac{c(SC{N}^{-})}{c(I)}$.
(1)向体积均为20.00mL、浓度均为0.1mol•L-1盐酸和醋酸溶液中分别滴加0.1mol•L-1NaOH溶液.随加入的NaOH溶液体积的增加,溶液pH的变化如图所示:
①用NaOH溶液滴定醋酸溶液的曲线是I(填“I”或“Ⅱ”);
②实验前,上述三种溶液中由水电离出的c(H+)最大的是CH3COOH溶液(填化学式);
③图中V1和V2大小的比较:V1< V2 (填“>”、“<”或“=”);
④图I中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) (用离子的物质的量浓度符号填空).
(2)为了研究沉淀溶解平衡,某同学查阅资料并设计了如下实验(相关数据测定温度及实验环境均为25℃):资料:AgSCN是白色沉淀;Ksp(AgSCN)=1.0×10-12;Ksp(AgI)=8.5×10-17
| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1KSCN溶液,静置. | 出现白色沉淀. |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1 Fe(NO3)3溶液. | 溶液变红色. |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1AgNO3溶液. | 出现白色沉淀,溶液红色变浅. |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1KI溶液. | 出现黄色沉淀. |
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为出现白色沉淀;溶液红色变浅(至少答出两条明显现象);
③写出步骤4中沉淀转化反应平衡常数的表达式:K=$\frac{c(SC{N}^{-})}{c(I)}$.

4.下列有关物质检验的实验结论中正确的组合是( )
| 实验操作 | 现象 | 实验结论 | |
| ① | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体一定是SO2 |
| ② | 将无色气体通入溴水中 | 溴水的黄色褪去 | 该气体可能是乙烯 |
| ③ | 向某溶液中滴入两滴KSCN溶液 | 溶液不显红色 | 该溶液一定含有Fe2+ |
| 另取该溶液少许,先滴入氯水,再 滴入KSCN溶液 | 溶液为红色 | ||
| ④ | 向某溶液中加入盐酸酸化的氯化钡 溶液 | 有白色沉淀产生 | 该溶液中可能含有SO42- |
| ⑤ | 将木炭和浓硫酸反应生成的气体通入 澄清石灰水中 | 有白色沉淀生成 | 该气体一定是CO2 |
| A. | ②④ | B. | ②③④ | C. | ①③⑤ | D. | ①②③④⑤ |
11.某硝酸钠固体中混有少量硫酸铵和碳酸氢钠杂质,现设计一实验方案,既除去杂质,又配成硝酸钠溶液.实验方案:先将固体溶于蒸馏水配成溶液,选择合适的试剂和操作完成表格中各步实验.下列试剂或操作不合理的是( )
| 选择试剂 | ① | Na2CO3溶液 | ④ |
| 实验操作 | ② | ③ | 加热 |
| A. | 试剂①为Ba(OH)2溶液 | B. | 操作②为结晶 | ||
| C. | 操作③为过滤 | D. | 试剂④为稀HNO3 |
1.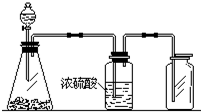 如图是一套实验室制气装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
如图是一套实验室制气装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
 如图是一套实验室制气装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
如图是一套实验室制气装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )| A. | 碳酸钙和稀盐酸 | B. | 二氧化锰和浓盐酸 | ||
| C. | 锌粒和稀硫酸 | D. | 碱石灰和浓氨水 |
5.下列说法正确的是( )
| A. | 将Ca(ClO)2、Na2SO3、FeCl3溶液蒸干可得到原溶质 | |
| B. | 因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 | |
| C. | 在新制氯水中各微粒浓度的关系为:2c(Cl2)=c(ClO?)+c(Cl?)+c(HClO) | |
| D. | 用1L 0.2 mol•L-1NaOH溶液分别吸收0.1molSO2、0.1mol CO2,所得的两种溶液中酸根离子浓度大小关系是:c(SO32- )>c(CO32-)>c(HCO3-)>c(HSO3-) |
6.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 1 mol Na2O2固体中含离子总数为4NA | |
| C. | 1mol羟基与17 g NH3所含电子数之比为9:10 | |
| D. | 一定温度下,1 L 0.5 mol•L-1 NH4Cl溶液与2 L 0.25 mol•L-1 NH4Cl溶液含NH${\;}_{4}^{+}$的物质的量相同 |
 路线:
路线:
 .
. .
.