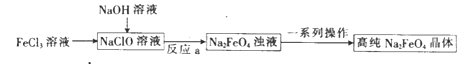题目内容
【题目】水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.
(1)水的净化和软化的区别是水的净化是用混凝剂将水中的胶体及悬浮物沉淀下来,而水的软化是;
(2)生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行杀菌消毒、混凝沉淀、过滤等工艺处理,这三项处理的正确顺序是;
(3)下列试剂能够用来对自来水进行杀菌消毒,且不会造成二次污染的是(填字母).
a.福尔马林 b.漂白粉 c.氯气 d.臭氧
(4)Na2FeO4是一种新型水处理剂,工业上可用FeSO4制备Na2FeO4其工艺流程如下: ![]()
①工业上常用硫酸亚铁作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH调到9左右,再加入绿矾.请解释这一做法的原因(用必要的离子方程式和文字描述).
②写出由Fe(0H)3制取Na2FeO4的化学方程式;
(5)石灰纯碱法是常用的硬水软化方法,已知25℃时Ksp(CaCO3)=2.8×10﹣9 , 现将等体积的Ca(OH)2溶液与Na2CO3溶液混合(假设溶液体积具有加和性),若Na2CO3溶液的浓度为5.6×10﹣5molL﹣1 , 则生成沉淀所需Ca(0H)2溶液的最小浓度为 .
【答案】
(1)除去水中较多的钙离子和镁离子
(2)混凝沉淀→过滤→杀菌消毒
(3)d
(4)Fe2+在碱性条件下易被氧化成Fe3+ , 进而水解生成Fe(OH)3胶体,起到较好的混凝作用,4Fe2++O2+2H2O+8OH﹣═4Fe(OH)3(胶体);2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O
(5)2×10﹣4mol/L
【解析】 解:(1)水的净化和软化的区别是水的净化是用混凝剂将水中的胶体及悬浮物沉淀下来,而水的软化是除去水中较多的钙离子和镁离子,所以答案是:除去水中较多的钙离子和镁离子;(2)生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行杀菌消毒、混凝沉淀、过滤等工艺处理,这三项处理的正确顺序是混凝沉淀→过滤→杀菌消毒,所以答案是:混凝沉淀→过滤→杀菌消毒;(3)福尔马林有毒,含氯物质可导致二次污染,则能够用来对自来水进行杀菌消毒,且不会造成二次污染的只有臭氧,所以答案是:d;(4)①工业上常用硫酸亚铁作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH调到9左右,再加绿矾,原因:Fe2+在碱性条件下易被氧化成Fe3+ , 进而水解生成Fe(OH)3胶体,起到较好的混凝作用,4Fe2++O2+2H2O+8OH﹣=4Fe(OH)3(胶体),所以答案是:Fe2+在碱性条件下易被氧化成Fe3+ , 进而水解生成Fe(OH)3胶体,起到较好的混凝作用,4Fe2++O2+2H2O+8OH﹣═4Fe(OH)3(胶体);②由Fe(0H)3制取Na2FeO4的化学方程式为2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O,所以答案是:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O;(5)Na2CO3溶液的浓度为5.6×10﹣5mol/L,等体积混合后溶液中c(CO32﹣)= ![]() ×5.6×10﹣5mol/L=2.8×10﹣5mol/L,根据Ksp=c(CO32﹣)c(Ca2+)=2.8×10﹣9可知,c(Ca2+)=
×5.6×10﹣5mol/L=2.8×10﹣5mol/L,根据Ksp=c(CO32﹣)c(Ca2+)=2.8×10﹣9可知,c(Ca2+)= ![]() mol/L=1×10﹣4mol/L,原溶液Ca(OH)2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液Ca(OH)2溶液的最小浓度为2×1×10﹣4mol/L=2×10﹣4mol/L,所以答案是:2×10﹣4mol/L.
mol/L=1×10﹣4mol/L,原溶液Ca(OH)2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液Ca(OH)2溶液的最小浓度为2×1×10﹣4mol/L=2×10﹣4mol/L,所以答案是:2×10﹣4mol/L.